Ablazione Vie anomale atrio-ventricolari (WPW)
Indice dell'articolo
Che cos’è la sindrome di Woff-Parkinson-White (WPW)?
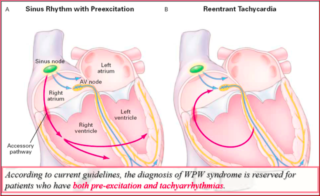
La sindrome di Wolff-Parkinson-White (WPW) è caratterizzata dalla associazione dei sintomi dovuti a tachiaritmie con la presenza di preeccitazione al tracciato ECG di superficie (pattern di WPW). Nella sindrome di WPW, le tachiaritmie sono dovute ad un fenomeno di macro-rientro atrio-ventricolare, che riconosce due vie anatomicamente definite di conduzione: Il sistema nodo-hissiano e la via accessoria atrio-ventricolare stessa. È sufficiente che tra queste due vie vi sia una differenza nel periodo refrattario o nella velocità di conduzione perchè si realizzi un circuito di rientro. Le tachicardie da rientro atrio-ventricolare (TRAV) si distinguono comunemente in ortodromiche ed antidromiche a seconda che la conduzione anterograda avvenga attraverso il sistema nodo-hissiano o attraverso la via accessoria.
Qual è il ruolo dello studio elettrofisiologico nei pazienti con WPW?
Lo studio elettrofisiologico in pazienti con WPW è utile per confermare la diagnosi, studiare la modalità di inizio delle tachicardie, localizzare le vie accessorie, dimostrare che la via accessoria partecipa alle tachicardie, valutare la refrattarietà della via accessoria e le sue implicazioni per il rischio di aritmie pericolose, l’interruzione delle tachicardie e il ruolo delle terapie farmacologiche, della stimolazione o dell’ablazione per le aritmie associate alla sindrome di WPW.
Gli episodi di TPSV ricorrente possono iniziare dalla prima infanzia, ma il loro esordio è più frequente durante l’adolescenza o l’età adulta; la fibrillazione atriale parossistica, d’altra parte, appare quasi esclusivamente negli adulti. Non è raro vedere segni di pre-eccitazione ECG alla nascita, che scompaiono dopo qualche tempo, poiché il percorso accessorio degenera e diventa fibrotico, diventando incapace di condurre; tuttavia la scomparsa dei segni di pre-eccitazione dell’ECG non significa necessariamente che vi sia una completa eliminazione della conduzione sul fascio di Kent, poiché sia la pre-eccitazione latente che nascosta non si associano al tipico schema ECG (onda delta, breve intervallo PR , ecc.) ma sono entrambi in grado di indurre aritmie (3).
Una percentuale estremamente bassa di pazienti con WPW muore improvvisamente a causa della fibrillazione ventricolare. Il meccanismo è quasi certamente una fibrillazione atriale con un’alta risposta ventricolare, che degenera in una fibrillazione ventricolare a causa dell’alta frequenza ventricolare. Questo è un evento drammatico che può verificarsi anche in soggetti asintomatici, con un’incidenza di 1 soggetto su 1000 all’anno. È stato osservato che tutti i pazienti con preeccitazione che sono stati rianimati da un arresto cardiaco avevano un breve periodo refrattario anterogrado (<250 ms) del percorso accessorio; sulla base di questi dati è stato proposto di considerare i pazienti “a rischio” con questo risultato elettrofisiologico (4). Tuttavia, il valore predittivo positivo di questo parametro è molto basso, poiché circa il 20% dei soggetti sottoposti a uno studio EP ha queste caratteristiche e dovrebbe pertanto essere considerato a rischio, mentre l’incidenza effettiva di morte improvvisa è considerevolmente inferiore.
Qual è il ruolo del mappaggio endocardio nella WPW?
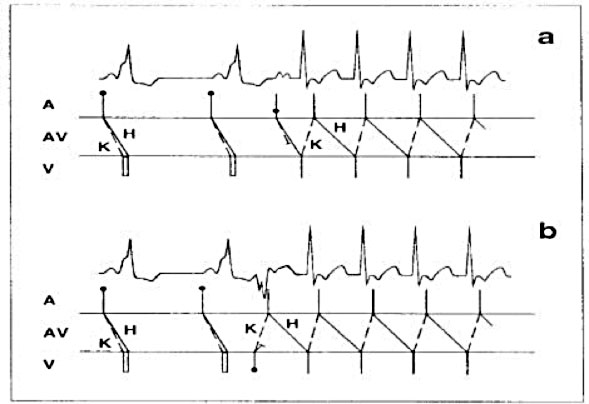
L’ECG può aiutare a localizzare le vie accessorie (AP), mentre lo studio elettrofisiologico e il mappaggio intracavitario forniscono dati precisi sulla sua posizione e sulle proprietà elettrofisiologiche delle vie accessorie. Al fine di definire la posizione esatta del fascio di Kent, viene eseguita la mappatura dell’anulus A-V al fine di trovare il punto con l’intervallo A-V più breve durante la conduzione anterograda sul fascio di Kent o l’intervallo VA più breve durante la stimolazione ventricolare o la tachicardia ortodromica. Questo tipo di mappatura può essere eseguita utilizzando registrazioni bipolari o unipolari ed è basato sul principio che l’attivazione della prima camera (ventricolare durante la conduzione anterograda, atriale durante la conduzione retrograda) consente di localizzare l’inserzione della via accessoria nella camera. Pertanto, il catetere ablatore deve essere posizionato sull’anello AV destro o sinistro, a contatto con l’endocardio, e quindi spostato fino a trovare l’intervallo di conduzione più breve. La posizione del catetere è confermata dalla fluoroscopia e dal potenziale registrato che è composto da due deflessioni, quella atriale e ventricolare. Se il catetere si trova sul fascio Kent, è facile registrare onde A e V quasi fuse, indicando un tempo di conduzione estremamente breve. A volte è persino possibile registrare il potenziale del fascio di Kent, visto come una rapida deflessione di breve durata, tra A e V, esprimendo la depolarizzazione della via accessoria: le onde A e V e il potenziale di Kent sono continui, e le diverse componenti sono difficili da separare. L’identificazione di tale attività elettrica continua indica fortemente la presenza di una via accessoria.
Mappatura Anterograda
Il primo sito di attivazione ventricolare durante la preeccitazione manifesta (ritmo sinusale preeccitato, AVRT antidromico) identifica il sito di inserzione ventricolare della via accessoria. I criteri del sito target per l’ablazione durante la mappatura anterogrado includono: 1) potenziale AP (potenziale Kent), 2) prima attivazione ventricolare locale relativa all’insorgenza dell’onda delta (pre-delta) e 3) fusione di elettrogrammi atriali e ventricolari. I potenziali del percorso accessorio riflettono una rapida attivazione locale della via accessoria e sono deflessioni acute e ad alta frequenza tra gli elettrogrammi atriali e ventricolari che precedono l’insorgenza dell’onda delta. Quanto più l’elettrogramma ventricolare locale sul catetere di ablazione precede l’insorgenza dell’onda delta, maggiore è la probabilità di successo.
Mappatura retrograda
Il primo sito di attivazione atriale durante la conduzione retrograda sulla via accessoria (stimolazione ventricolare, AVRT ortodromica) identifica il suo sito di inserzione atriale. Una limitazione della mappatura durante la stimolazione ventricolare dipende dalla possibilità che la conduzione retrograda sul nodo AV possa interferire con l’identificazione del primo sito di attivazione atriale sulla via accessoria (in particolare, vie accessorie settali settali). Le potenziali soluzioni includono la stimolazione a una velocità maggiore (per causare decremento o blocco nel nodo AV), la somministrazione di farmaci che rallentano la conduzione nodale AV o la mappatura durante l’AVRT ortodromica (dove la conduzione retrograda si verifica solo sulle vie accessorie). I criteri per definire il sito per l’ablazione includono: 1) potenziali sulle vie accessorie, 2) il primo sito di attivazione atriale e 3) fusione di elettrogrammi A e V.
Sulla base delle raccomandazioni delle linee guida ACC / AHA / ESC del 2019, nel caso di preeccitazione asintomatica è consigliata l’esecuzione del test EP nel giovane, nell’atleta e nei soggetti in cui i test non invasivi suggeriscano una situazione non a basso rischio. Nei soggetti con WPW asintomatici in cui il test EP con l’uso dell’isoprenalina evidenzia proprietà ad alto rischio, come SPERRI <250 ms, AP ERP <250 ms, vie accessorie multiple e tachicardia mediata da via accessoria inducibile, si pone indicazione di classe I per l’ATC-RF.
Quali sono le caratteristiche delle tachicardie mediate dalle vie accessorie atrio-ventricolari (AVRT)?
Le tachicardie più comuni associate alla sindrome di WPW sono le tachicardie da circuito, il 95% delle quali sono ortodromiche; cioè conducono in modo anterogrado verso il basso rispetto al normale sistema di conduzione A-V e retrogrado sul tratto di bypass. La relazione di conduzione e refrattarietà del normale sistema di conduzione A-V e del tratto di bypass, nonché il sito di stimolazione, determinano sia la capacità di iniziare il circuito della tachiaritmia, sia, teoricamente, il tipo di tachicardia. La conduzione e la refrattarietà delle vie accessorie nella maggior parte dei casi si comportano come tessuto muscolare contrattile; pertanto, le vie accessorie dimostrano una rapida conduzione e presentano periodi refrattari che tendono ad accorciarsi con la riduzione delle lunghezze del ciclo di stimolazione (PCL).
La sindrome di WPW consente di verificare la presenza di tutti i requisiti per un ritmo rientrante: (a) due percorsi anatomici determinanti dal punto di vista funzionale; (b) blocco unidirezionale in uno dei percorsi (in questo caso, nel percorso accessorio o nel percorso A-V nodale); (c) un rallentamento sufficiente in una parte del circuito per superare la refrattarietà prima dell’impulso circolante; e (d) il tempo di conduzione dell’impulso deve superare il periodo refrattario effettivo più lungo di qualsiasi componente nel circuito. Sia il periodo refrattario anterogrado sia quello retrogrado della via accessoria sono i principali determinanti delle: (a) capacità di iniziare e sostenere il movimento circolare, e (b) risposta ventricolare alle tachiaritmie atriali (ad es. fibrillazione atriale, flutter atriale e tachicardia atriale) .
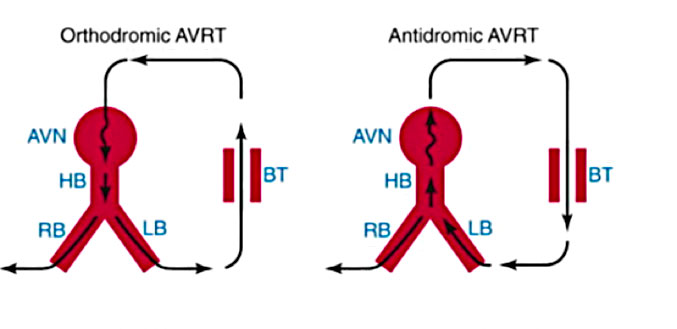
La AVRT è una aritmia rientrante ed è classificata in varianti ortodromiche e antidromiche. Durante la tachicardia ortodromica, la via anterograda è il sistema del nodo AV-His-Purkinje e la via retrograda è la via accessoria. Al contrario, durante la tachicardia antidromica, la via anterogrado è la via accessoria e la via retrograda è il normale sistema di conduzione. La AVRT ortodromica costituisce circa il 95% degli AVRT spontanei e indotti in laboratorio. Per l’inizio della tachicardia, un complesso prematuro atriale (APC), spontaneo o indotto dalla stimolazione, si blocca sulla via accessoria e viaggia lungo il nodo AV-His-Purkinje. L’impulso condotto raggiunge il ventricolo e ritorna sull’atrio sulla via accessoria, che ora ha recuperato la sua eccitabilità. L’impulso quindi rientra nel sistema AV-His-Purkinje, perpetuando la tachicardia. La tachicardia ortodromica può anche essere iniziata da un complesso ventricolare prematuro (PVC). In questo caso, il PVC blocca il sistema His-Purkinje ma viaggia sulla via accessoria fino all’atrio. Se il sistema AV-His-Purkinje del nodo ha recuperato l’eccitabilità, l’impulso quindi viaggia lungo il nodo e rientra nel ventricolo e viene avviata la tachicardia ortodromica
Quali sono gli obiettivi nel trattamento della sindrome di WPW?
La terapia di pre-eccitazione ha quattro obiettivi diversi: 1. Curare i sintomi; 2. Prevenire il rischio di morte improvvisa; 3. Prevenire o curare, in caso di tachicardia cronica, il peggioramento della funzione ventricolare; 4. Consentire ai soggetti con pre-eccitazione di svolgere tutte le attività che sono altrimenti vietate legge quando è presente la preeccitazione sull’ECG, ad esempio negli sportivi agonisti o nei lavoratori di professioni a rischio.
Negli altri casi, la terapia non è indicata: in particolare nei soggetti asintomatici, che presentano solo la preeccitazione all’ECG, non è necessario alcun trattamento, una volta verificata l’assenza di parametri di rischio nelle proprietà elettrofisologiche delle vie accessorie, dato tranne che in rari casi, il rischio di sviluppare aritmie pericolose è molto limitato.
Esistono quattro diversi tipi di approcci terapeutici: farmaci antiaritmici, ablazione transcataetere delle vie accessorie, ablazione chirurgica delle vie accessorie, terapia elettrica (cardioversione, stimolazione).
Quali sono i trattamenti farmacologici delle AVRT nel WPW?
Nella AVRT ortodromica, il nodo AV è l’anello debole e i farmaci che prolungano la refrattarietà nodale AV o deprimono la sua conduzione possono portare a un blocco nel nodo con conseguente interruzione della tachicardia. Le manovre vagali terminano la tachicardia causando il blocco nel nodo. I farmaci di prima linea che sono efficaci nella terminazione acuta dell’AVRT ortodromico includono la somministrazione di adenosina, verapamil o diltiazem o beta-bloccanti per via I.V. La digossina è meno efficace a causa dell’inizio ritardato dell’azione. Tra i farmaci antiaritmici di classe 1a, la procainamide è una valida alternativa, dato che deprime la conduzione, prolunga la refrattarietà nella maggior parte dei tessuti cardiaci (cioè atrio, ventricolo e sistema His-Purkinje) e blocca anche la conduzione nella via accessoria. I farmaci antiaritmici di classe Ic sono più efficaci dei farmaci di classe Ia nel bloccare la conduzione AP; tuttavia, dovrebbero essere evitati nei pazienti con cardiopatia strutturale. L’amiodarone ha vari effetti elettrofisiologici ma non è più efficace dei farmaci di classe Ic usati da soli o in combinazione con i beta-bloccanti. In generale, l’amiodarone dovrebbe essere riservato a coloro che sono candidati refrattari ai farmaci, anziani e non idonei alla terapia ablativa. Il sotalolo può essere efficace nella prevenzione della tachicardia, sebbene sia associato a un rischio del 4% di torsioni di punta, specialmente in quelli con significative malattie cardiache strutturali e insufficienza cardiaca congestizia. La digossina orale non è efficace come monoterapia per l’AVRT ortodromica e, per i suoi effetti diretti sula via accessoria, questo farmaco può effettivamente accelerare la conduzione sulla via accessoria durante la fibrillazione atriale. Pertanto, la digossina non deve mai essere utilizzata per il trattamento di pazienti con pre-eccitazione.
Nell’AVRT antidromico, la conduzione nodale AV retrograda può essere l’anello debole del circuito di rientro. I bloccanti dei canali del calcio, beta-bloccanti e adenosina possono essere utilizzati per la cessazione acuta della tachicardia. La procainamide IV è il farmaco di scelta nel trattamento acuto della AVRT antidromica. Anche questo farmaco non interrompe la tachicardia, può rallentare il tasso di tachicardia. In assenza di controindicazioni, i farmaci di classe 1c sono i farmaci di scelta per il trattamento orale a lungo termine della tachicardia antidromica.
Come si effettua l’ablazione transcatetere in radiofrequenza nel WPW?
L’ablazione trancatetere in radiofrequenza (ATC-RF) è la procedura di scelta per i pazienti con sindrome WPW sintomatica e per coloro che rispondono male alla terapia medica. Nei centri più esperti, il tasso di successo è compreso tra il 95% e il 97% con un tasso di ricorrenza del 6%. Il successo dell’ablazione dipende in modo critico dall’accurata localizzazione della via accessoria. La localizzazione del percorso preliminarmente può essere ottenuta dalle morfologie dell’onda delta e del QRS (vedi localizzazione delle vie accessorie dall’ECG di superficie).
In genere, lo studio elettrofisiologico endocavitario precede l’ablazione della via accessoria permettendo la sua esatta localizzazione. La procedura di ablazione viene eseguita in anestesia locale ed una blanda sedazione farmacologica. Si ottengono mediante la tecnica di Seldinger plurimi accessi venosi (in genere femorale destro e succlavio sinistro). Qualora la via accessoria abbia una localizzazione sinistra si posiziona anche un accesso arterioso (arteria femorale destra) al fine di poter permettere l’ablazione mediante approccio transaortico. In alternativa è possibile raggiungere le camere cardiache sinistre mediante la puntura transettale.
Gli elettrocateteri diagnostici quadripolari vengono posizionati a livello dell’atrio destro alto, del fascio di His, in apice del ventricolo destro e nel seno coronarico (vena cardiaca che circonda in solco atrio ventricolare sinistro e permette di registrare l’attività elettrica nella parte sinistra del cuore).
L’ablazione consiste nel somministrare in prossimità della via accessoria energia termica (radiofrequenza) al fine di creare un danno cellulare irreversibile e di renderla pertanto elettricamente inerte.
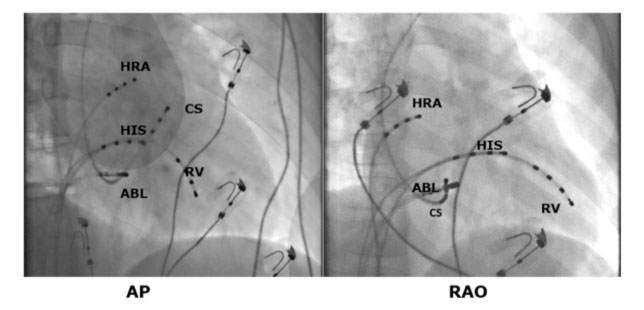
Qualora la preccitazione ventricolare sia manifesta in corso di studio elettrofisiologico si mappano gli anelli valvolari e si identifica dove sia presente la più precoce attivazione ventricolare od il caratteristico potenziale di Kent.
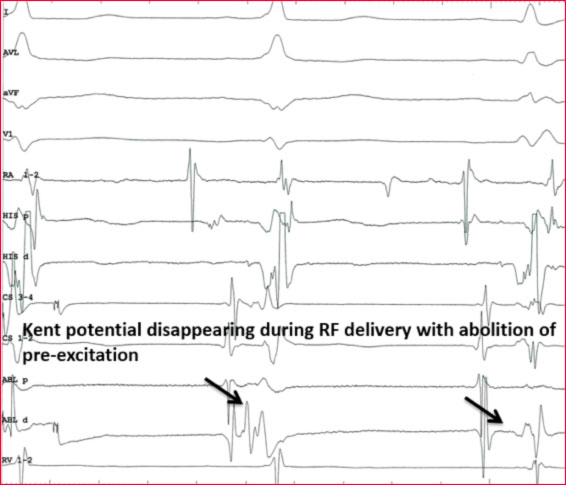
Alcune manovre di pacing atriale o ventricolare possono essere d’aiuto qualora la via accessoria non sia immediatamente identificabile.
Quando la pre-eccitazione non è massima, la stimolazione atriale rapida o l’adenosina I.V. può essere utilizzata per ottenere la pre-eccitazione completa in modo da migliorare l’accuratezza della localizzazione. Ciò è particolarmente utile nelle vie accessorie laterali di sinistra in cui la pre-eccitazione può essere migliorata con la stimolazione atriale sinistra (dal seno coronarico, CS, catetere). I criteri dell’elettrogramma intracardiaco (8) utilizzati per identificare i siti target appropriati per l’ablazione delle vie manifeste comprendono la presenza di un potenziale lungo al avia accessoria (Fig. 5), l’inizio precoce dell’attivazione ventricolare locale rispetto all’insorgenza dell’onda delta, la stabilità dell’elettrogramma e l’attività elettrica continua anterograda (elettrodi atriali e ventricolari fusi).
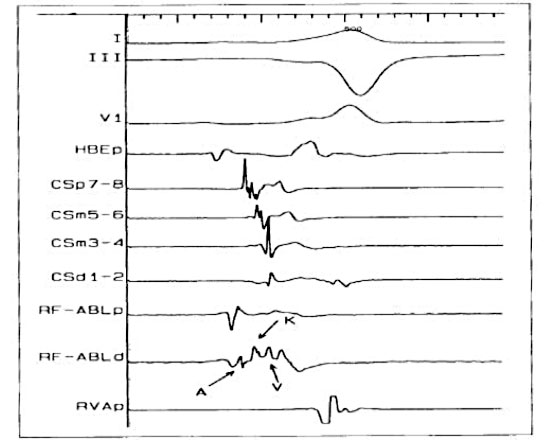
Quali sono i criteri per scegliere l’approccio per la ATCRF delle vie anomale?
I criteri utilizzati per identificare i siti target appropriati per l’ablazione della via nascosta e includono la presenza di potenziale retrogradi lungo la via accessoria, attività elettrica continua retrograda con stimolazione ventricolare o durante tachicardia e stabilità dell’elettrogramma. L’ablazione può essere guidata dal catetere in seno coronarico utilizzato per fissare la posizione del percorso. La via anomala può essere ablata tramite un approccio trans-settale o trans-aortico retrogrado a seconda dell’esperienza e delle preferenze dell’operatore. In assenza di un PFO, l’approccio trans-settale prevede la puntura attraverso la fossa ovale. Con l’approccio trans-aortico, la punta del catetere di ablazione è ricurvata per evitare di danneggiare le arterie coronarie, avanzando per via retrograda attraverso la valvola aortica nel ventricolo sinistro e posizionata lungo l’anello mitralico.
L’ablazione del catetere è associata a un tasso di successo molto elevato. La corretta ablazione dei percorsi delle pareti libere a destra richiede una mappatura dettagliata dell’anulus tricuspidale laterale. Il tasso di successo complessivo per l’ablazione della parete libera del ventricolo destro è il più basso di tutte le vie accessorie, con una media del 90% e un tasso di ricorrenza del 14%. Le ragioni della riduzione del tasso di successo includono l’instabilità del catetere e la mancanza di una struttura simile a seno coronarico sul lato destro, parallelo all’anello tricuspidalico, per facilitare la mappatura.
L’ablazione delle vie antero-settale e mediana può essere difficile a causa della vicinanza al nodo A-V e del fascio di His; tuttavia è associata con un tasso di successo complessivo dal 95% al 98% e un rischio dall’1% al 3% di blocco A-V permanente. L’ablazione delle vie postero-settali può essere impegnativa a causa della complessa anatomia della zona postero-settale. La maggior parte delle vie postero-settali può essere ablata dal lato destro, sebbene nel 20% dei casi sia necessario un approccio sul lato sinistro (Fig. 6).
Gli aspetti ECG ed elettrofisiologici che suggeriscono la necessità di un approccio sul lato sinistro includono un’onda delta positiva o un complesso QRS positivo in V1, la prima attivazione atriale retrograda all’ostio del seno coronarico (CS) e un aumento dell’intervallo VA con presenza di BBSX durante la tachicardia ortodromica.
Una piccola percentuale delle vie accessorie ha sede epicardica. Tra il 5% e il 17% degli AP postero-settali e posteriori si trovano a livello epicardico ed è necessaria l’ablazione tramite CS (più comunemente tramite la vena cardiaca media). La presenza di vie accessorie epicardiche potrebbe essere suggerito dalla scoperta di potenziali piccoli o assenti durante la mappatura endocardica e potenziali di dimensioni più ampie durante la mappatura a livello del CS. Le vie accessorie epicardiche sul lato sinistro possono essere ablate con successo all’interno del CS in caso di vie con alti potenziali. Tuttavia, l’ablazione di vie accessorie in altri siti epicardici può richiedere un approccio epicardico percutaneo, in alternativa alla chirurgia cardiaca.
Nel complesso, l’ablazione di AP è associata a un tasso di complicanze dall’1% al 4% e un tasso di mortalità correlato alla procedura di circa lo 0,2%. La complicazione del blocco A-V completo si verifica in circa l’1% dei pazienti e si riscontra più frequentemente nei pazienti sottoposti ad ablazione delle vie settali. La disfunzione autonomica e la tachicardia sinusale inappropriata sono rare complicanze dell’ablazione a radiofrequenza delle vie accessorie atrio-ventricoalri e sono meno frequenti di quelle osservate nell’ablazione della AVNRT. Oggi, i progressi nella progettazione degli elettrocateteri, dei sistemi di erogazione di energia, dei sistemi di mappaggio e dei sistemi di navigazione robotica remota hanno reso l’ablazione transcatetere la terapia di scelta per la maggior parte delle tachiardie da macrorientro (ARVT E AVNRT).
Presenza di vie accessorie multiple.
In circa il 10-15% dei soggetti con pre-eccitazione sono presenti più vie accessorie. I dati istopatologici mostrano una frequenza più elevata di vie accessorie multiple rispetto a quelli osservati clinicamente. La presenza di vie accessorie multiple aumenta l’incidenza dei sintomi ed è associata a un rischio più elevato di morte improvvisa dovuta alla fibrillazione atriale che degenera in fibrillazione ventricolare. I pazienti con pre-eccitazione resuscitati da morte improvvisa avevano un’incidenza più elevata di vie accessorie multipli rispetto al gruppo di controllo che non aveva avuto un arresto cardiaco (5). La diagnosi di vie accessorie multiple sull’ECG è possibile, anche se non in tutti i casi.
DI SEGUITO VENGONO ILLUSTRATI ESEMPI DI PROCEDURE DI ABLAZIONE IN SITUAZIONI SPECIFICHE
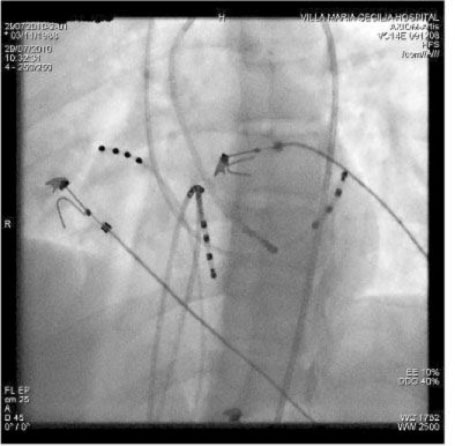
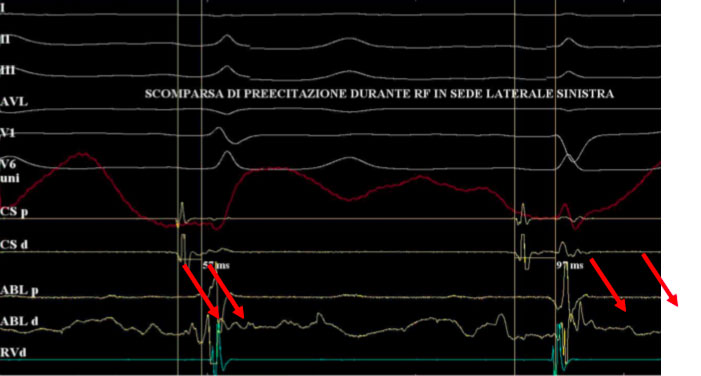
Ablazione di un AP postero-settale sinistro manifesto mediante approccio trans-aortico retrogrado (proiezione LAO). Il catetere di ablazione è posizionato lungo l’anulus mitrale postero-settale dove registra un potenziale sulla vie accessorie tra gli elettrogrammi atriale e ventricolare. L’applicazione di energia RF in questo sito ha causato la perdita di preeccitazione in pochi secondi. Il catetere CS fornisce un utile riferimento di riferimento all’anello mitrale.
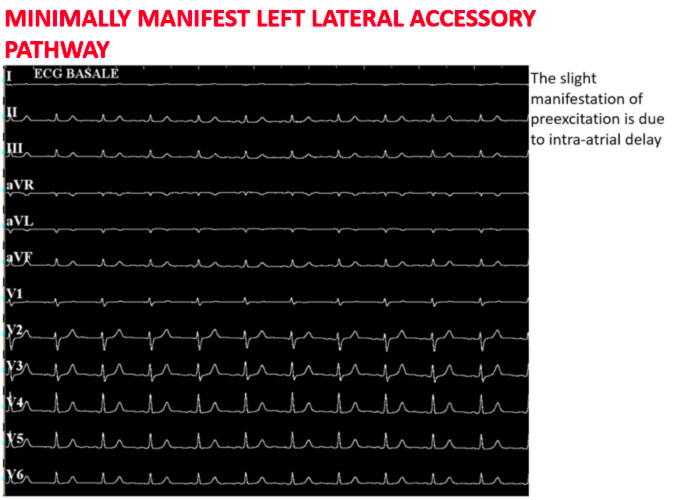
La figura sopra mostra come in condizioni basali siano poco evidenti i segni di preeccitazione ventricolare
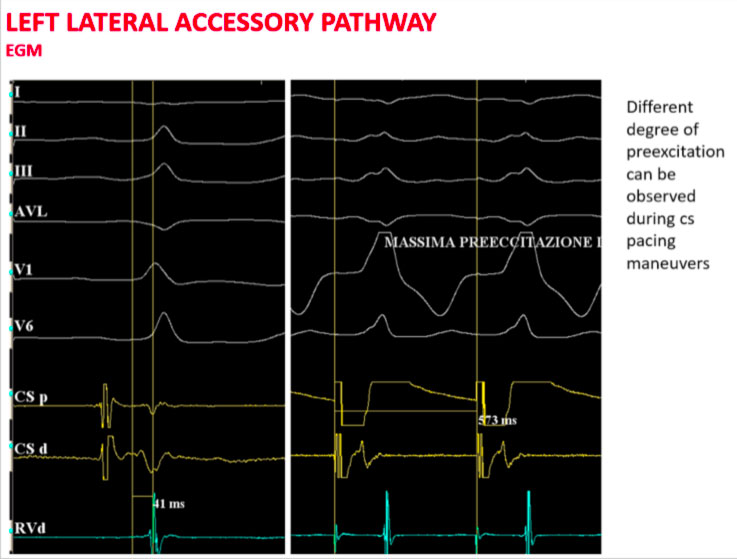
Procedendo con una stimolazione asincrona dal seno coronarico si aumenta il grado di preeccitazione ventricolare con il più breve intervallo AV individuabile in prossimità del seno coronarico distale.
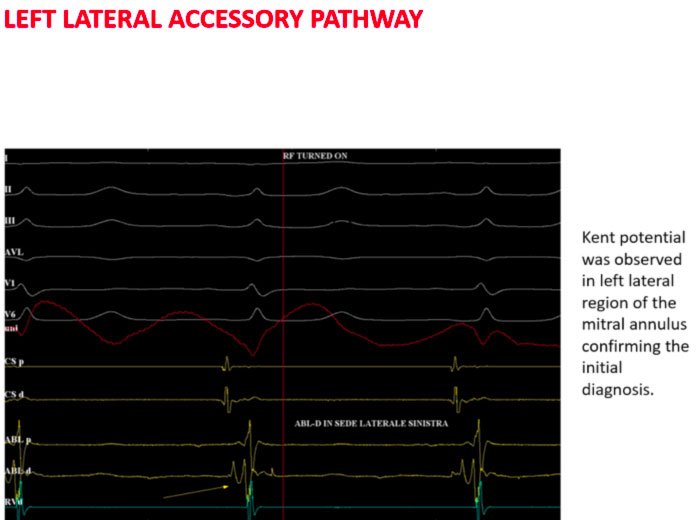
Nel caso di cui sopra ad esempio si posiziona per via trans-aortica il catetere ablatore in posizione laterale sinistra e si registra sul dipolo distale il tipico potenziale di Kent
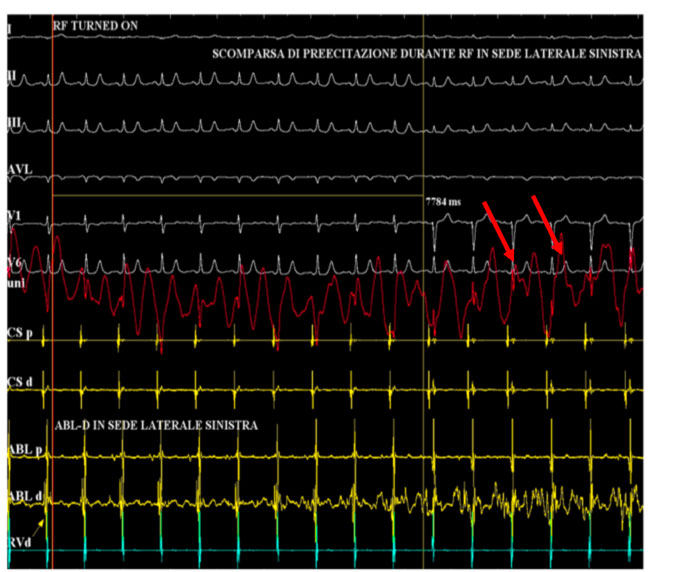
In tale sede si eroga radiofrequenza con scomparsa della preeccitazione ventricolare
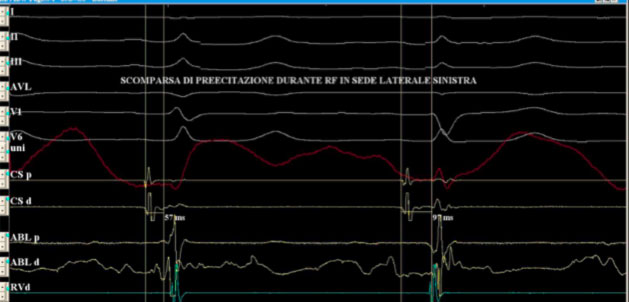
Si noti come il segnale atriale e ventricolare appaiano più distanziati sul dipolo in seno coronarico.
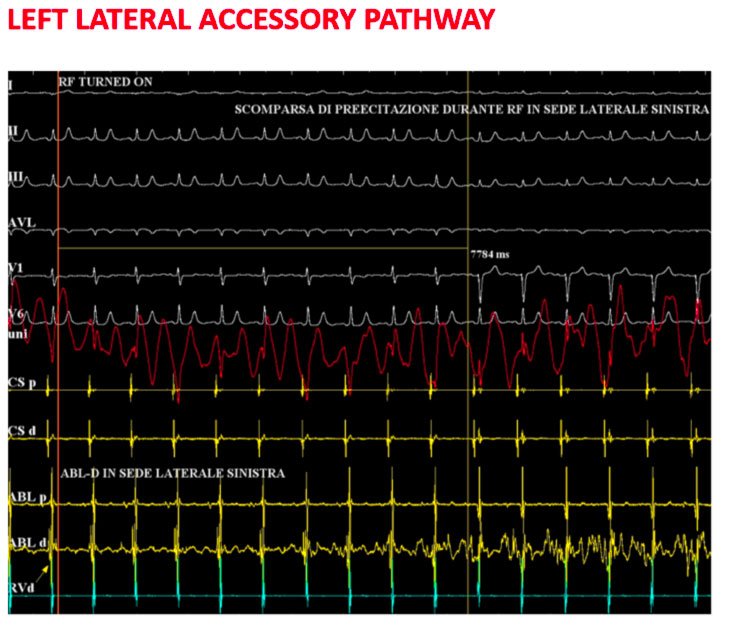
Al termine della procedura di ablazione l’eletrocardiogramma non mostra più le stigmate della preeccitazione e si ottiene quindi una completa normalizzazione dello stesso.
Talora le vie accessorie possono andare a complicare altre patologie aritmiche come la tachicardia da rientro nodale o la fibrillazione atriale. Proprio quest’ultima quando associata alla preeccitazione ventricolare può costituire una vera emergenza clinica a causa della mancanza di “filtro” del nodo atrio ventricolare e dell’elevata risposta ventricolare conferita dal basso periodo refrattario della via accessoria.
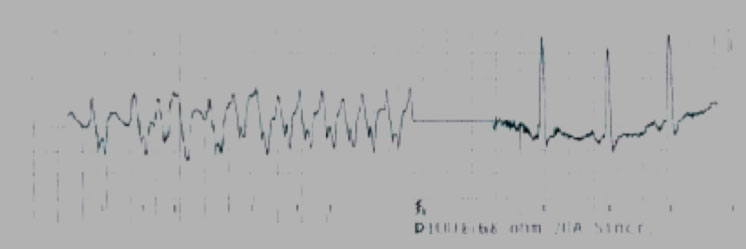
Alcune manovre di pacing atriale o ventricolare possono essere d’aiuto qualora la via accessoria non sia immediatamente identificabile.
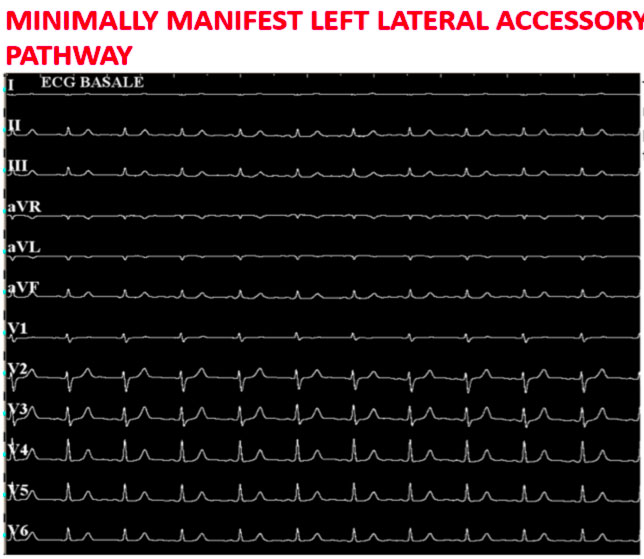
La figura sopra mostra come in condizioni basali siano poco evidenti i segni di preeccitazione ventricolare
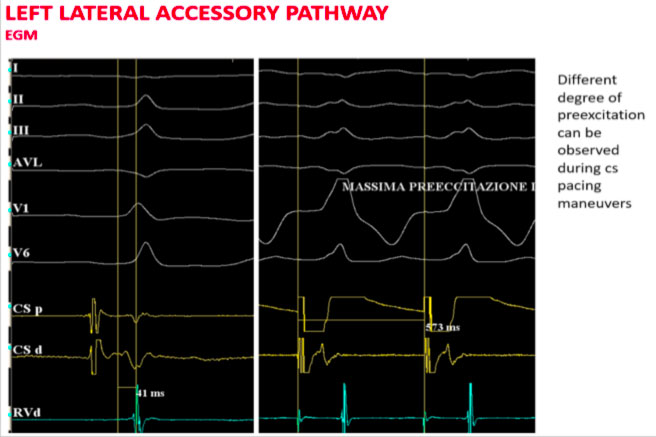
Procedendo con una stimolazione asincrona dal seno coronarico si aumenta il grado di preeccitazione ventricolare con il più breve intervallo AV individuabile in prossimità del seno coronarico distale.
Nel caso di cui sopra ad esempio si posiziona per via trans-aortica il catetere ablatore in posizione laterale sinistra e si registra sul dipolo distale il tipico potenziale di Kent
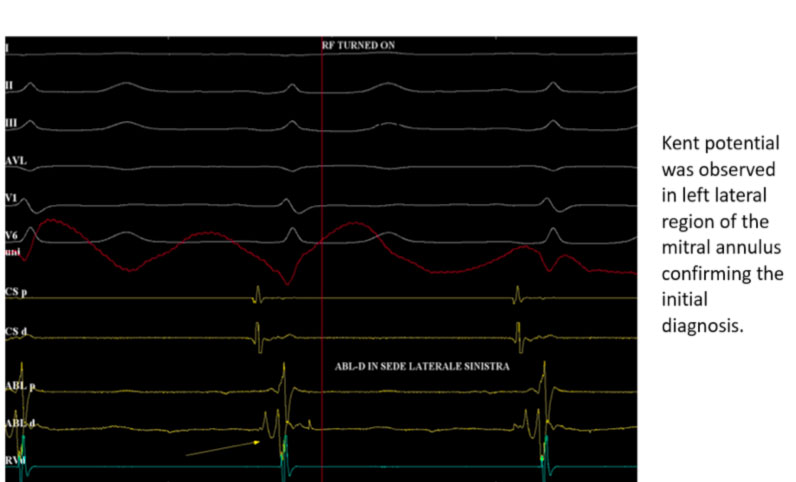
In tale sede si eroga radiofrequenza con scomparsa della preeccitazione ventricolare
Si noti come il segnale atriale e ventricolare appaiano più distanziati sul dipolo in seno coronarico.
Al termine della procedura di ablazione l’eletrocardiogramma non mostra più le stigmate della preeccitazione e si ottiene quindi una completa normalizzazione dello stesso.
Quando è raccomandata l’ablazione transcatetere nei soggetti asintomatici con WPW?
Attualmente l’importanza dello studio elettrofisiologico (EP) e dell’ablazione transcatatere (ATCRF) delle vie accessorie sono ben stabiliti nei pazienti sintomatici con sindrome di WPW. Sulla base delle raccomandazioni delle linee guida ACC / AHA / ESC del 2019, nel caso di preeccitazione sintomatica dato l’ATCRF ha un’indicazione di classe I.
L’approccio ai pazienti asintomatici è meno chiaro. La maggiore sicurezza dello studio EP e delle tecniche di ablazione basate su catetere forniscono un impulso all’ablazione profilattica del percorso. A supporto di ciò, studi randomizzati hanno dimostrato che nei centri di aritmia con esperienza l’ablazione profilattica in pazienti asintomatici che risultano essere ad alto rischio di aritmie riduce il rischio di aritmie potenzialmente letali.
Qual è il ruolo della ablazione chirurgica nel WPW??
Il trattamento chirurgico elettivo di WPW è stato sostanzialmente abbandonato. Fino agli anni ’80 diversi pazienti sono stati sottoposti a interventi chirurgici al fine di interrompere la conduzione sull’AP, ma da quando è diventata disponibile l’ablazione del catetere è stato universalmente accettato che il rapporto rischio / beneficio di tale intervento chirurgico era inaccettabile, poiché risultati migliori sono stati ottenuti utilizzando metodi più semplici e meno traumatici.
Qual è il ruolo della terapia elettrica nel WPW?
La terapia elettrica di pre-eccitazione si basa sulla cardioversione, che viene utilizzata in caso di fibrillazione atriale pre-eccitata e raramente per AVRT, e sulla stimolazione atriale o ventricolare in caso di tachicardia rientrante. La stimolazione atriale può essere eseguita attraverso la via endocavitaria o transesofagea, mentre la stimolazione ventricolare solo tramite quella endocavitaria. Questo tipo di approccio è consigliabile nei soggetti in cui non è possibile la somministrazione di farmaci o un AVRT non si interrompe dopo le manovre vagali e non è ben tollerato.
Quali sono i parametri di rischio di aritmie pericolose nel WPW?
A differenza del nodo AV, le vie accessorie non dimostrano una conduzione decrementale dipendente dalla frequenza che rallenta con frequenze atriali più veloci. Le seguenti caratteristiche identificano vie accessorie a basso rischio: 1) preeccitazione intermittente, 2) blocco della via accessoria indotto dall’esercizio, 3) intervallo RR preeccitato più breve durante AF> 250 ms e 4) perdita di preeccitazione con procainamide, ajmalina o disopiramide (7). La preeccitazione intermittente dimostra che la via accessoria non è in grado di sostenere la conduzione 1: 1 durante il ritmo sinusale e, pertanto, non può condurre rapidamente durante la FA.
Allo stesso modo, la brusca perdita di preeccitazione durante l’esercizio dimostra che la via accessoria non è in grado di sostenere una conduzione 1:1 durante la tachicardia sinusale indotta dall’esercizio. Durante l’esercizio fisico, la perdita improvvisa di preeccitazione (blocco della via accessoria dipendente dalla frequenza) deve essere differenziata dalla perdita graduale di preeccitazione (pseudonormalizzazione) dovuta a una migliore conduzione nodale AV. Durante la pseudonormalizzazione, la via accessoria continua a condurre in modo anterogrado, ma l’onda delta scompare lentamente man mano che aumenta il contributo all’attivazione ventricolare da parte del sistema AV-His-Purkinje. Poiché il periodo refrattario effettivo anterogrado (ERP) è correlato all’intervallo RR atteso più breve durante la FA, un ERP anterogrado lungo la via accessoria o una durata del ciclo di stimolazione atriale mantenendo una conduzione 1:1 più breve di 250 ms è un surrogato ragionevole ma non ideale del minimo intervallo RR nei casi in cui la FA è assente.
1. Santinelli V, Radinovic A, Manguso F, Vicedomini G, Gulletta S, G Paglino, Mazzone P, Ciconte G, Sacchi S, Sala S, Pappone C. The natural history of asymptomatic ventricular preexcitation. A long-term prospective follow-up study of 184 asymptomatic children. J Am Coll Cardiol. 2009; 53: 275-280. Impact factor: 11.438 2. Santinelli V, Radinovic A, Manguso F, Vicedomini G, Ciconte G, Gulletta S, Paglino G, Sacchi S, Sala S, Ciaccio C, Pappone C. Asymptomatic ventricular preexcitation: A long-term prospective follow-up study of 293 adult patients. Circ Arrhythmia Electrophysiol 2009; 2:102-107. 3. Pappone C and Santinelli V. Remote ablation of accessory pathways. Eur Heart J.2008 Feb; 29 (3): 422. Impact Factor: 8.917 4. Pappone C, Radinovic A and Santinelli V. Sudden death and ventricular preexcitation: is necessary to treat the asymptomatic patients? Curr Pharmac Design. 2008; 14 (8) 762-765. Impact factor 4.399 5. Triedman J, Perry J, Van Hare G, Pappone C, Santinelli V. Risk Stratification for Prophylactic Ablation in Asymptomatic Wolff–Parkinson–White Sindrome. The N ew England Journal of Medicine 2005; 352(1): 92-93. Impact Factor: 50.017 6. Pappone C and Santinelli V. Catheter ablation should be performed in asymptomatic patients with Wolff-Parkinson-White syndrome. Circulation. 2005 Oct 4;112(14):2207- 2215. Impact factor: 14.595 7. Pappone C, Santinelli V, Rosanio S, Vicedomini G, Nardi S, Pappone A, Tortoriello V, Manguso F, Mazzone P, Gulletta S, Oreto G, Alfieri O. Usefulness of invasive electrophysiologic testing to stratify the risk of arrhithmic events in asymptomatic patients with Wolff-Parkinson-White Pattern. Results from a large prospective longterm follow-up.study. J Am Coll Cardiol. 2003; 41, 2: 239-244. Impact factor: 11.438