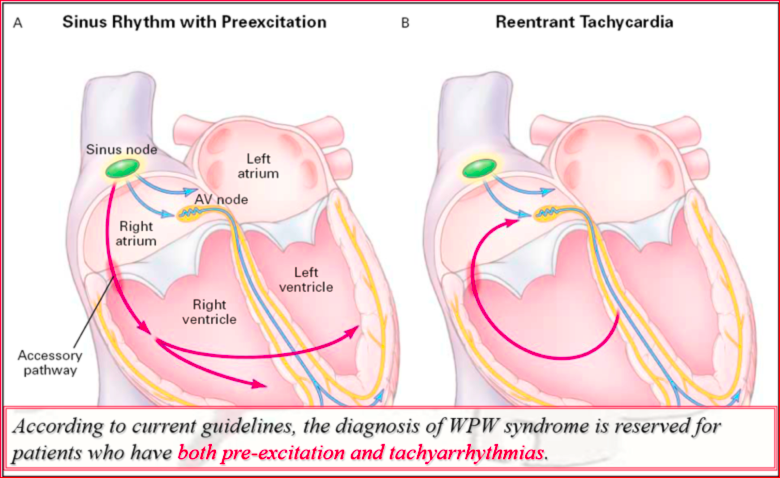
Sindrome di Wolff-Parkinson White (WPW): tachicardia da rientro atrio-ventricolare
Indice dell'articolo
Che cos’è la sindrome di Wolff Parkinson-White (WPW)?
Nel 1930, i dottori Wolff, Parkinson e White riferirono di 11 pazienti giovani e sani con particolari caratteristiche ECG, che includevano un breve intervallo di PR e un’anomalie della conduzione intraventricolare tipo blocco di branca. Questi pazienti soffrivano di parossismi di TPSV. Questo quadro clinico alla fine divenne noto come sindrome di Wolff-Parkinson-White (WPW). Inizialmente si pensava che le anomalie del complesso QRS fossero correlati a un breve PR e un blocco di branca; Kent ha proposto per la prima volta la presenza di connessioni extranodali atrio-ventricolari per spiegare la pre-eccitazione ventricolare. Una delle principali ragioni dell’interesse per la sindrome di WPW nel corso degli anni è stata la morbilità e la mortalità associate. Esiste una relazione consolidata tra la presenza di sintomi e il rischio di morte improvvisa (SD). Nei pazienti asintomatici con WPW la percentuale di SD è bassa ed è stimata in circa 1 su 1.000 pazienti-anno. In un giovane paziente sintomatico con sindrome di WPW, l’incidenza di SD durante la vita è stata stimata tra il 3% e il 4% circa. In alcuni pazienti, la fibrillazione ventricolare è stata la prima manifestazione di questa sindrome.
Qual è la presentazione clinica della sindrome di WPW?
La sindrome di WPW può occorrere in presenza di cuore strutturalmente sano, oppure può essere associata a numerose condizioni cardiache, tra cui varie forme di cardiopatia congenita. Numerose segnalazioni delineano l’associazione dell’anomalia di Ebstein con la sindrome di WPW, con fino al 5% dei pazienti affetto da entrambe le condizioni in alcune serie di casi. Negli adulti è stata osservata un’associazione tra vie accessorie sinistre e il prolasso della valvola mitrale. Le vie accessorie sinistre sembrano essere le più comuni, tuttavia, poiché il prolasso della valvola mitrale è comune anche nella popolazione di pazienti, la loro associazione può in effetti rappresentare la coesistenza di due condizioni relativamente comuni.
E’ importante notare che il concetto di “pattern di WPW” si riferisce alla presenza di preeccitazione ventricolare all’ECG di superficie, mentre la “sindrome di WPW” è l’associazione pattern WPW con i sintomi dovuti alle tachiaritmie. Di tutti i pazienti che mostrano segni di preeccitazione all’ECG di superficie, solo circa il 50% sviluppa sintomi durante la loro vita. Poiché la sindrome di WPW è caratterizzata dall’associazione di alterazioni elettrocardiografiche e aritmie, si può dire che solo il 45-50% dei pazienti che presentano preeccitazione su ECG a 12 derivazioni soffre di sindrome di WPW.
Quali sono le tachicardie da rientro atrio-ventricolare?
Le tachicardie parossistiche sopraventricolari (TPSV) da rientro sono tachiaritmie originate dal tessuto sopraventricolare che hanno come meccanismo patogenetico un circuito di rientro dovuto alla presenza di una via accessoria che collega direttamente gli atri e i ventricoli, by-passando il nodo atrio-ventricolare. Il substrato del circuito di rientro per le aritmie sopraventricolari è generalmente congenito, pertanto, il paziente tipico con tachicardia sopraventricolare da rientro è giovane e altrimenti sano, senza evidenza di cardiopatia strutturale.
Le cause più comuni di TPSV da rientro comprendono la tachicardia rientrante nodale (AVNRT), seguita dalla tachicardia rientrante atrioventricolare (AVRT), che dipende dalla presenza di una via accessoria atrio-ventricolare (accessory pathways, AP), tipica della sindrome di Wolff-Parkinson-White (WPW). Anche il meccanismo della TPSV sembra essere influenzato dall’età e dal sesso: la AVRT è più comune nella popolazione pediatrica, mentre l’età di insorgenza dei sintomi nei pazienti con AVNRT è quasi un decennio più tardi rispetto a quelli con AVRT. L’incidenza e la prevalenza di TPSV aumentano con l’avanzare dell’età; per tutte le fasce d’età, le donne hanno il doppio delle probabilità di sviluppare TPSV rispetto agli uomini. La AVRT da sindrome di WPW tende ad essere più frequente nei maschi rispetto alle femmine, sebbene la differenza si riduca con l’aumentare dell’età, a causa della progressiva perdita di preeccitazione dovuta alla progressiva degenerazione fibrotica di molte vie accessorie. Al contrario, la AVNRT (come anche la tachicardia atriale, AT) è più frequente nelle femmine rispetto ai maschi.
Nella sindrome di WPW, la tachicardia da rientro atrio ventricolare è una tachicardia macroreentrante che riconosce due vie anatomicamente definite di conduzione: Il sistema nodo hissiano e la via accessoria stessa. È sufficiente che tra queste due vie vi sia una differenza nel periodo refrattario o nella velocità di conduzione perchè si realizzi un circuito di rientro. Le tachicardie da rientro atrio ventricolare si distinguono comunemente in ortodromiche ed antidromiche a seconda che l’anteroconduzione avvenga attraverso il sistema nodo hissiano o attraverso la via accessoria.
Quali sono le vie accessorie nella sindrome di WPW?
Le vie accessorie sono dei fasci muscolari anomali attraverso i quali l’impulso elettrico può by-passare il fisiologico sistema di conduzione nodo-hissiano.
La preeccitazione esiste quando, in relazione agli eventi atriali, tutto o parte del muscolo ventricolare viene attivato dall’impulso atriale prima di quanto ci si aspetterebbe se l’impulso raggiungesse i ventricoli solo attraverso il normale sistema di conduzione atrioventricolare (A-V). Le sindromi da preeccitazione sono state precedentemente classificate sulla base delle connessioni anatomiche proposte descritte dagli eponimi fibre Kent, fibre James e fibre Mahaim.
A seconda delle strutture che collegano si distinguono:
- Le vie accessorie tipo Kent: quelle che collegano il tessuto atriale a quello ventricolare (vie atrio-ventricolari))
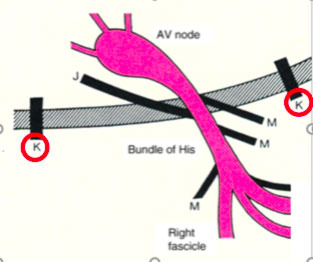
- Le vie accessorie tipo James, che collegano il tessuto atriale alla porzione distale del nodo atrio ventricolare compatto (vie atrio-nodali)
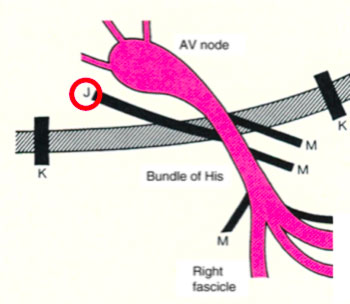
- Le vie accessorie a sede atipica che comunemente vengono definite come di Mahahim e che possono collegare l’atrio al fascio di His (atrio-hissiane); il fascio di His al ventricolo (fascicolo-ventricolari), il nodo AV compatto alle porzioni distale dell’His-Purkinje (nodo-ventricolari)
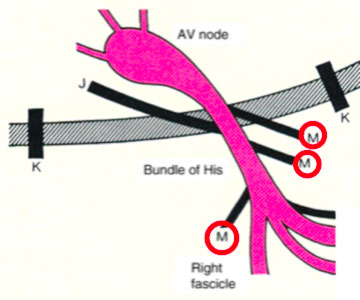
Quando dotate di conduzione anterograda, le vie accessorie si manifestano all’ECG di superficie con dei particolari segni :
- Intervallo PR corto (< 120 msec)
- Impastamento iniziale del complesso QRS (onda delta)
- Slargamento del complesso QRS (> 120 msec)
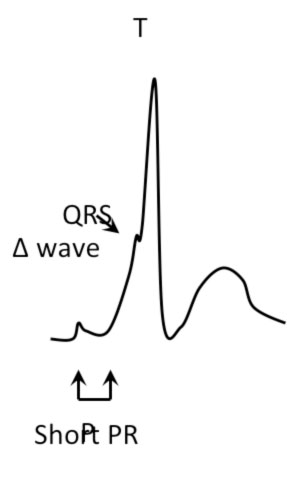
Talora la preeccitazione ventricolare può essere occulta o non manifesta.
Le vie accessorie occulte vengono definite come dotate della sola proprietà di retroconduzione.
Le vie accessorie non manifeste sono al contrario caratterizzate da proprietà elettrofisiologiche di anteroconduzione sovrapponibili o inferiori a quelle del normale sistema di conduzione hissiano, tali per cui in condizioni basali non sono visibili.
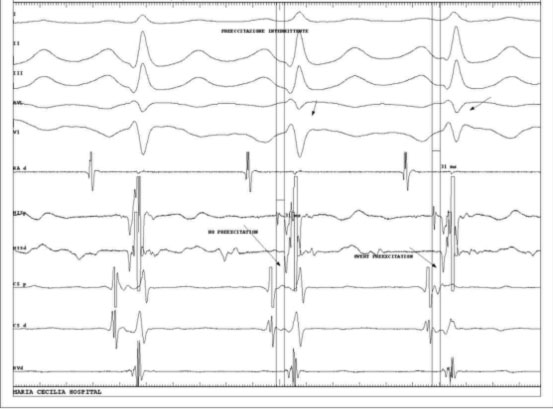
Altro caso è quello della preeccitazione ventricolare intermittente, in cui la preccitazione ventricolare non è sempre presente a causa delle proprietà di antero-conduzione della stessa.
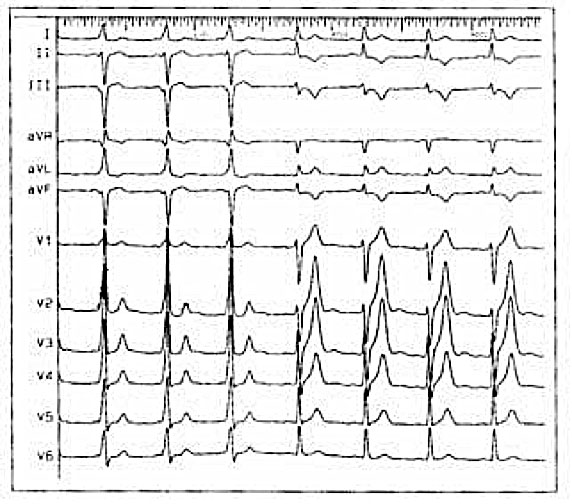
Come si localizzano le vie accessorie nella WPW?
Le vie accessorie possono localizzarsi in qualunque sede a livello dell’anulus tricuspidalico o mitralico conferendo così un particolare pattern elettrocardiografico dal quale è possibile fare diagnosi presunta di localizzazione. Alcuni pazienti inoltre possono avere più di una via accessoria.
Le vie accessorie si trovano ovunque lungo gli anelli tricuspidali o mitralici, tranne che nella continuità mitro-aortica. I parametri ECG per identificare la posizione approssimativa di una via accessoria sono: 1) l’asse dell’onda delta durante la preeccitazione manifesta e 2) l’asse dell’onda P durante l’AVRT ortodromica.
Asse dell’onda Delta
La transizione QRS sull’asse orizzontale nel precordio anteriore (V1-V4) differenzia AP a sinistra, settale dal lato destro, mentre l’asse verticale dell’onda delta-determina la sua posizione anteriore o posteriore lungo l’annulus. La transizione QRS precoce (in corrispondenza o prima di V1) indica un AP al lato sinistro perché le forze ventricolari iniziali sono dirette anteriormente verso il ventricolo destro. Onde delta negative nelle derivazioni laterali (I, aVL) o inferiori identificano rispettivamente un AP della parete libera sinistra o un AP della parete posteriore sinistra. La transizione orizzontale a V2, che sovrasta il setto interventricolare, indica un AP postero-medio-settale destro. La transizione tardiva (uguale o superiore a V3) indica un AP lato destro. Gli AP anteroseptali mostrano un modello di tipo blocco di branca sinistro (BBS) con transizione prima di V4, somma delle polarità dell’onda delta nelle derivazioni inferiori (II, III, aVF) ≥ +2 e un asse QRS frontale da +30 a +120 gradi.
Asse dell’onda P durante AVRT
Le polarità dell’onda P durante l’AVRT ortodromico differenziano via accessorie del lato sinistro, settale e lato destro. Un asse dell’onda P verso destra (positivo in aVR, negativo in aVL) indica l’attivazione atriale derivante da un AP del lato sinistro, mentre un asse verso sinistra (positivo in aVL, negativo in aVR) identifica l’attivazione atriale da un AP del lato destro. Gli AP postero-settali medi generano una linea mediana, asse superiore (ugualmente positivo in aVL e aVR), mentre gli AP antero-settali producono onde P positive inferiormente.
Sono qui di seguito mostrati schemi che facilitano la localizzazione anatomica delle vie accessorie:
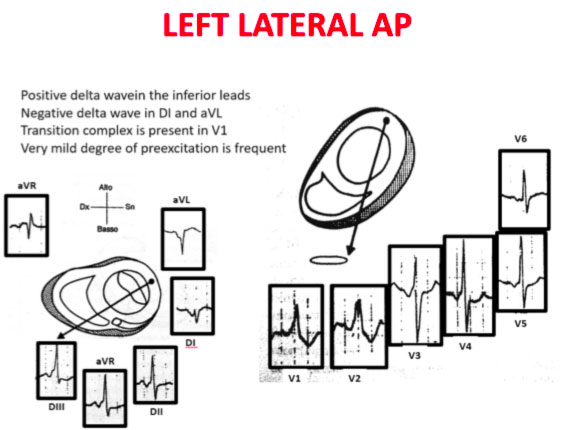
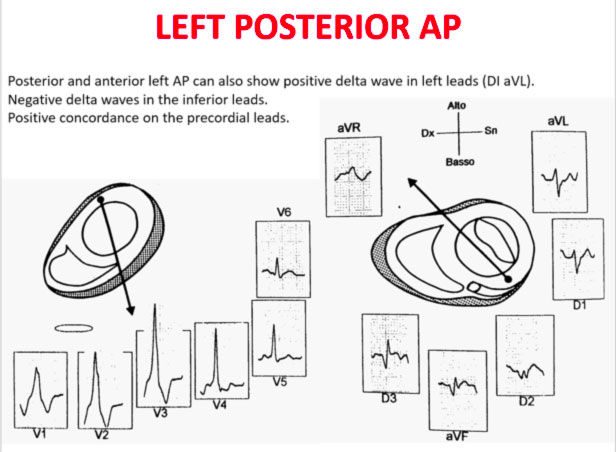
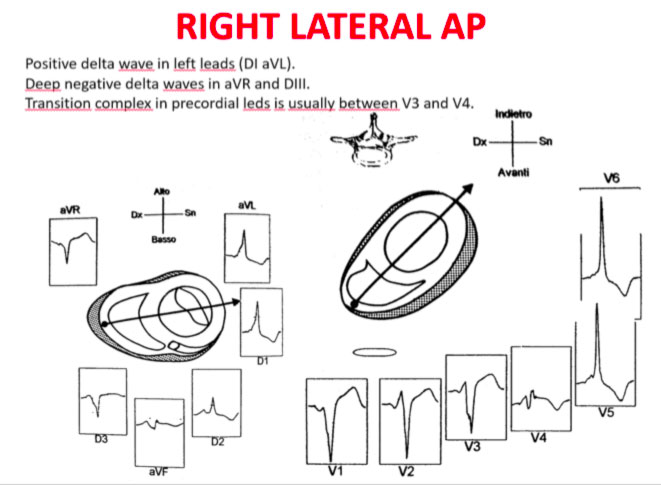
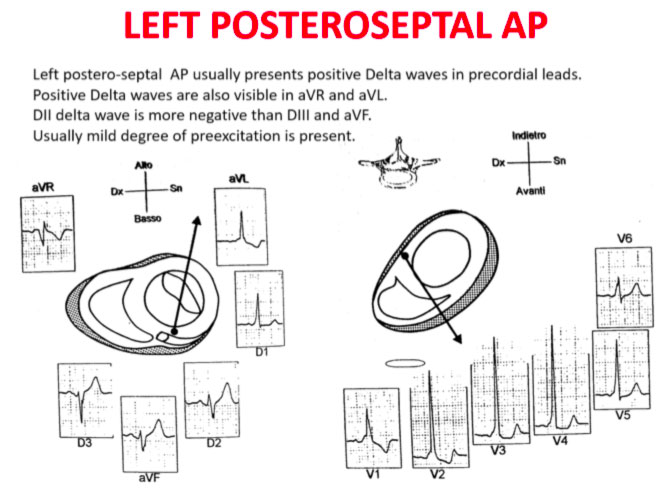
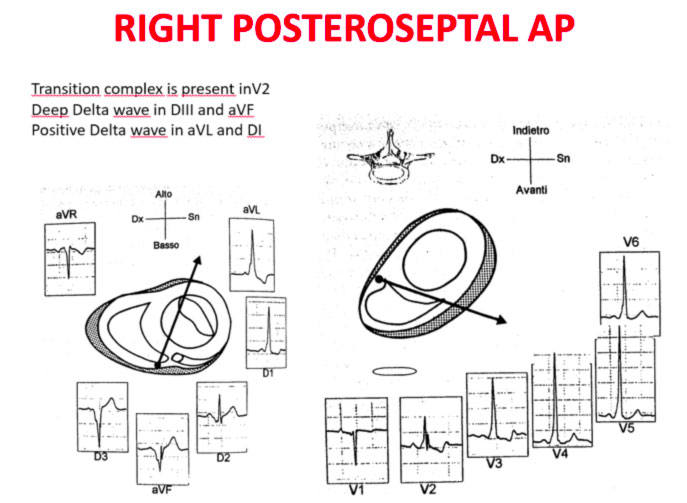
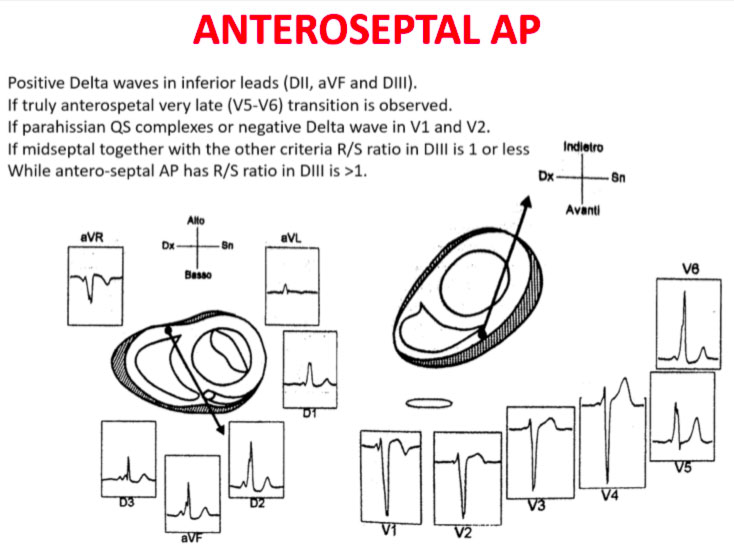
Gli errori nella localizzazione dell’AP sono generalmente dovuti alla preeccitazione minima sull’ECG di superficie, agli AP multipli (2-20% dei pazienti) e alla deformità toracica o alla cardiopatia congenita. Pertanto, la localizzazione della via ccessoria mediante ECG di superficie e indicattiva, ma è necessaria una mappatura intracardiaca dettagliata per effettuare l’ablazione della via accessoria.
Quali sono gli obiettivi nel trattamento della sindrome di WPW?
La terapia di pre-eccitazione ha quattro obiettivi diversi: 1. Curare i sintomi; 2. Prevenire il rischio di morte improvvisa; 3. Prevenire o curare, in caso di tachicardia cronica, il peggioramento della funzione ventricolare; 4. Consentire ai soggetti con pre-eccitazione di svolgere tutte le attività che sono altrimenti vietate legge quando è presente la preeccitazione sull’ECG, ad esempio negli sportivi agonisti o nei lavoratori di professioni a rischio.
Negli altri casi, la terapia non è indicata: in particolare nei soggetti asintomatici, che presentano solo il pattern di WPW in assenza di sintomi aritmici e una volta esclusi specifici fattori di rischio attraverso i test non invasivi ed eventualmente invasivi, non è necessario alcun trattamento, poiché il rischio di sviluppare aritmie pericolose è molto limitato.
Esistono quattro diversi tipi di approcci terapeutici: farmaci antiaritmici, ablazione transcatetere delle vie accessorie atrio-ventricolari, ablazione chirurgica dell’AP, terapia elettrica (cardioversione, stimolazione).
Qual è il ruolo dello studio elettrofisiologico e dell’ablazione trancsatetere nei pazienti con WPW?
Lo studio elettrofisiologico in pazienti con WPW è utile per confermare la diagnosi, studiare la modalità di inizio delle tachicardie, localizzare le vie accessorie, dimostrare che la via accessoria partecipa alle tachicardie, valutare la refrattarietà della via accessoria e le sue implicazioni per il rischio di aritmie pericolose, l’interruzione delle tachicardie e il ruolo delle terapie farmacologiche, della stimolazione o dell’ablazione per le aritmie associate alla sindrome di WPW.
Gli episodi di TPSV ricorrente possono iniziare dalla prima infanzia, ma il loro esordio è più frequente durante l’adolescenza o l’età adulta; la fibrillazione atriale parossistica, d’altra parte, appare quasi esclusivamente negli adulti. Non è raro vedere segni di pre-eccitazione ECG alla nascita, che scompaiono dopo qualche tempo, poiché il percorso accessorio degenera e diventa fibrotico, diventando incapace di condurre; tuttavia la scomparsa dei segni di pre-eccitazione dell’ECG non significa necessariamente che vi sia una completa eliminazione della conduzione sul fascio di Kent, poiché sia la pre-eccitazione latente che nascosta non si associano al tipico schema ECG (onda delta, breve intervallo PR , ecc.) ma sono entrambi in grado di indurre aritmie (3).
Qual è il rischio di morte improvvisa nei pazienti con WPW?
Una percentuale estremamente bassa di pazienti con WPW muore improvvisamente a causa della fibrillazione ventricolare. Il meccanismo è quasi certamente una fibrillazione atriale con un’elevata risposta ventricolare, che degenera in una fibrillazione ventricolare a causa dell’alta frequenza ventricolare. Questo è un evento drammatico che può verificarsi anche in soggetti asintomatici, con un’incidenza di 1 soggetto su 1000 all’anno. È stato osservato che tutti i pazienti con preeccitazione che sono stati rianimati da un arresto cardiaco avevano un breve periodo refrattario antegrado (<250 ms) del percorso accessorio; sulla base di questi dati è stato proposto di considerare i pazienti “a rischio” con questo risultato elettrofisiologico (4). Tuttavia, il valore predittivo positivo di questo parametro è molto basso, poiché circa il 20% dei soggetti sottoposti a uno studio EP ha queste caratteristiche e dovrebbe pertanto essere considerato a rischio, mentre l’incidenza effettiva di morte improvvisa è considerevolmente inferiore.
1. Santinelli V, Radinovic A, Manguso F, Vicedomini G, Gulletta S, G Paglino, Mazzone P, Ciconte G, Sacchi S, Sala S, Pappone C. The natural history of asymptomatic ventricular preexcitation. A long-term prospective follow-up study of 184 asymptomatic children. J Am Coll Cardiol. 2009; 53: 275-280. Impact factor: 11.438 2. Santinelli V, Radinovic A, Manguso F, Vicedomini G, Ciconte G, Gulletta S, Paglino G, Sacchi S, Sala S, Ciaccio C, Pappone C. Asymptomatic ventricular preexcitation: A long-term prospective follow-up study of 293 adult patients. Circ Arrhythmia Electrophysiol 2009; 2:102-107. 3. Pappone C and Santinelli V. Remote ablation of accessory pathways. Eur Heart J.2008 Feb; 29 (3): 422. Impact Factor: 8.917 4. Pappone C, Radinovic A and Santinelli V. Sudden death and ventricular preexcitation: is necessary to treat the asymptomatic patients? Curr Pharmac Design. 2008; 14 (8) 762-765. Impact factor 4.399 5. Triedman J, Perry J, Van Hare G, Pappone C, Santinelli V. Risk Stratification for Prophylactic Ablation in Asymptomatic Wolff–Parkinson–White Sindrome. The N ew England Journal of Medicine 2005; 352(1): 92-93. Impact Factor: 50.017 6. Pappone C and Santinelli V. Catheter ablation should be performed in asymptomatic patients with Wolff-Parkinson-White syndrome. Circulation. 2005 Oct 4;112(14):2207- 2215. Impact factor: 14.595 7. Pappone C, Santinelli V, Rosanio S, Vicedomini G, Nardi S, Pappone A, Tortoriello V, Manguso F, Mazzone P, Gulletta S, Oreto G, Alfieri O. Usefulness of invasive electrophysiologic testing to stratify the risk of arrhithmic events in asymptomatic patients with Wolff-Parkinson-White Pattern. Results from a large prospective longterm follow-up.study. J Am Coll Cardiol. 2003; 41, 2: 239-244. Impact factor: 11.438 8. Pappone C, Santinelli V, Manguso F, Augello G, Santinelli O, Vicedomini G, Gulletta G, Mazzone P, Tortoriello V, Pappone A, Dicandia C, and Rosanio S. A Randomized Study of Prophylactic Catheter Ablation in Asymptomatic Patients with the Wolff–Parkinson–White Syndrome. The N ew England Journal of Medicine 2003 Nov 6; 349:1803-1811. Impact factor: 50.017 9. Pappone C, Stabile G, Oreto G, De Simone A, Rillo M, Mazzone P, Cappato R, Chierchia S Inappropriate sinus tachycardia after radiofrequency ablation of para- Hisian accessory pathways. J Cardiovasc Electrophysiol. 1997 Dec; 8 (12): 1357-1365. Impact factor: 3.798 10. Pappone C, Lamberti F, Stabile G, De Simone A, Santomauro M, Turco P, Senatore G, ChiarielloM. Radiofrequency ablation in Wolff-Parkinson-White syndrome: Criteria for identification of ideal ablation sites. New Trends in Arrhythmias 1993; 9 (3): 393