Sindrome di Brugada (SdB)
Indice dell'articolo
CHE COS’È LA SINDROME DI BRUGADA?
La sindrome di Brugada (BrS) è una cardiopatia su base genetica in grado di provocare varie manifestazioni aritmologiche, con un aumentato rischio di morte improvvisa.
Le aritmie possono esordire a qualsiasi età, anche se si manifestano più frequentemente durante l’età adulta, tra i 25-45 anni. Si stima che la BrS sia responsabile di almeno il 4% di tutte le morti improvvise e tra queste di almeno il 20% delle morti di pazienti con cuore apparentemente strutturalmente normale.
La maggior parte delle diagnosi di BrS avviene in seguito a casi di morte improvvisa nelle famiglia o a seguito del work-up diagnostico di sintomi, quali palpitazioni, sincope o arresto cardiaco. La BrS è presente sia nel sesso femminile che maschile, con una significativa e tutt’ora inspiegata prevalenza nel sesso maschile.
La BrS presenta un quadro elettrocardiografico caratteristico, rappresentato da un tipico sovraslivellamento a tenda del tratto ST nelle derivazioni elettrocardiografiche precordiali destre (da V1 a V3), detto pattern di Brugada tipo 1. Nei casi in cui il quadro elettrocardiografico è sospetto, ma non diagnostico (pattern di Brugada tipo 2 o 3), per confermare o escludere la diagnosi può essere necessario effettuare un test con farmaci antiaritmici di classe I (es. ajmalina o flecainide, farmaci bloccanti dei canali del sodio), che slatentizzano il tipico pattern di Brugada.
QUANTO È DIFFUSA LA SINDROME DI BRUGADA?
Sin dalla sua prima descrizione, la BrS ha suscitato grande interesse sia per la sua alta incidenza in alcune parti del mondo sia perché associata ad un incrementato rischio di morte cardiaca improvvisa in particolare nei maschi nella terza e quarta decade di vita.
Infatti, nel corso di questi ultimi anni, c’è stato un drammatico aumento nel numero di casi riportati ed una grande proliferazione di pubblicazioni scientifiche sull’argomento. Una prima Consensus Conference tenutasi nel 2002 ha definito i criteri diagnostici per la sindrome, una seconda Consensus Conference nel 2005 ha posto attenzione sulla stratificazione del rischio e sulle terapie.
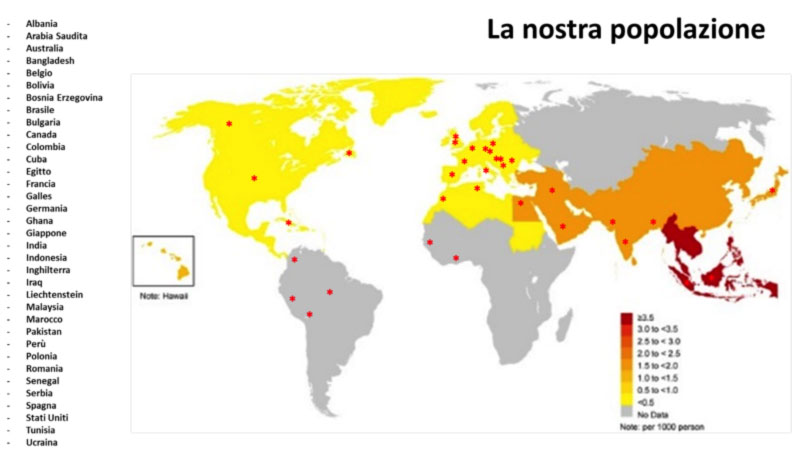
Si stima che la prevalenza della sindrome di Brugada nella popolazione generale sia attorno a 5 casi ogni 10.000 individui (ovvero circa 0.05%). La malattia è presumibilmente diffusa in tutto il mondo, con incidenza simile in Europa e negli Stati Uniti, tendenzialmente ancora più elevata nei paesi asiatici (Figura 1). La frequenza è più bassa nei paesi occidentali e più alta nel Sud-Est asiatico specialmente in Tailandia e nelle Filippine dove la sindrome di Brugada è considerata la causa principale di morte improvvisa in giovani individui. In questi paesi, la sindrome è spesso definita come SUNDS (sudden unexplained nocturnal death syndrome).
La malattia è probabilmente la principale causa di morte nei pazienti al di sotto dei 40 anni di età. In ogni caso la patologia sembra essere sottostimata, a causa delle difficoltà di diagnosi, dovute al fatto che il primo sintomo è spesso la morte improvvisa, e che il pattern elettrocardiografico caratteristico è molto variabile nel tempo.
A QUALE ETA’ SI MANIFESTA LA SINDROME DI BRUGADA?
La sindrome di Brugada tipicamente si manifesta nell’età giovanile ed adulta, generalmente dopo l’adolescenza, con età media alla presentazione dei sintomi di circa 40 anni (41 ± 15 anni nella nostra casistica). Tipicamente gli uomini manifestano la malattia più frequentemente delle donne (con un rapporto di circa 5:1 nella nostra casistica). Più raramente la BrS si manifesta in età pediatrica, e potrebbe spiegare alcuni casi di sindrome della morte in culla (sudden infant death syndrome, o SIDS).
QUALI SONO LE CARATTERISTICHE GENETICHE DELLA SINDROME DI BRUGADA?
La BrS è una malattia genetica attualmente ritenuta a trasmissione autosomica dominante, anche se recentemente sono stati proposti meccanismi più trasmessi di trasmissione genetica; pertanto la probabilità di trasmettere la patologia può arrivare al 50% per ogni eventuale gravidanza di un paziente affetto. Nella nostra casistica abbiamo anche osservato che la consanguineità determina in genere rischi di ricorrenza superiori.
Secondo i dati della letteratura, nei pazienti con BrS viene identificata almeno una mutazione genica in circa il 35% dei casi, e in circa 50% di essi è presente una mutazione nel gene SCN5A, coinvolto nella funzione del canale del sodio, mentre i rimanenti casi presentano anomalie in percentuale variabile in altri di altri geni.
Recentemente il nostro gruppo ha pubblicato sullo European Heart Journal un articolo (Brugada syndrome genetics is associated with phenotype severity.) in cui dimostriamo che i pazienti portatori di mutazione sul gene SCN5A hanno manifestazioni aritmologiche più frequenti e gravi dei pazienti non portatori di tali mutazioni.
L’indagine genetica, eseguita a partire da un semplice prelievo di sangue, è quindi importante sia per la gestione clinica del paziente in termine di stratificazione del rischio, che per l’identificazione di eventuali altri familiari affetti.
Nel caso quindi di probandi con sospetto clinico di BrS, nel nostro Centro lo screening genetico viene effettuato su campione ematico attraverso la metodica NGS (Next Generation Sequencing) su un pannello di 40 geni (ABCC9, AKAP9, CACNA1C, CACNA2D1, CACNB2, DSC, DSG2, DSP, JUP, GPD1L, HCN4, KCND2, KCND3, KCNE3, KCNE5, KCNE1L, KCNH2, KCNJ8, MOG1, PKP2, PLN, MYBPC3, MYH6, MYH7, MYL3, MYPN, RANGRF, SCN5A, SCN10A, SCN1B, SCN2B, SCN3B, SEMA3A, TRPM4, TNNC1, TNNI3, TNNT2, TPN1, SCTA1, TRDN).
Se vuoi saperne di più >> La nostra esperienza nelle cardiopatie genetiche.
| La sindrome di Brugada rappresenta uno dei focus principali dell’attività clinica e di ricerca del nostro Centro. Ad oggi sono state studiate nel nostro Centro oltre 300 famiglie affette da BrS, e per piu’ di 1000 pazienti tra probandi e familiari. |
PERCHE’ EFFETTUARE LO SCREENING FAMILIARE IN CASO DI SOSPETTA SINDROME DI BRUGADA?
Data l’origine genetica della sindrome, indagare la storia familiare è molto importante. I pazienti con BrS possono avere storia familiare positiva per morte improvvisa in età giovanile (cioè un’età inferiore ai 50 anni) per cause non note. Altre aspetti che meritano ulteriore approfondimento sono l’eventuale presenza di familiari con diagnosi di epilessia oppure una storia di aborti ripetuti o morti infantili inspiegate in famiglia.
Nel caso in cui, durante lo screening familiare, vengano individuati familiari affetti, dovrà essere valutata la necessità di eseguire ulteriori approfondimenti per la stratificazione dell’eventuale rischio aritmico.
QUALI SONO I SEGNI ELETTROCARDIOGRAFICI DELLA SINDROME DI BRUGADA?
L’elettrocardiogramma (ECG) del paziente affetto può variare molto nel tempo, anche all’interno di una stessa giornata, passando da momenti in cui il tracciato è sostanzialmente normale ad altri in cui diventa francamente patologico.
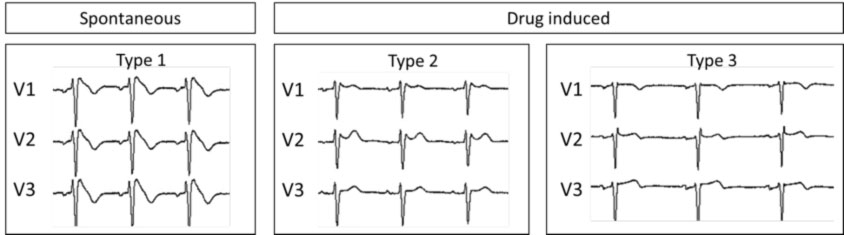
La malattia può presentare tre differenti quadri ECG (detto anche “fenotipi” ECG), di cui solo il Tipo 1 è effettivamente diagnostico per sindrome di Brugada (Figura 2).
- TIPO 1 è il cosiddetto “sopraslivellamento del tratto ST coved type“, con un sopraslivellamento del punto J di almeno 2 mm (con morfologia “a tenda”) ed una graduale discesa del segmento ST ed un’onda T negativa in V1 e V2.
- Tipo 2 presenta il cosiddetto “saddle-back pattern” (“aspetto a sella”), con un sopraelevamento del punto J di almeno 2 mm ed un sopraslivellamento del tratto ST di almeno 1 mm con un’onda T positiva o bifasica.
- Tipo 3 presenta il cosiddetto “saddle-back pattern” con un sopraelevamento del punto J inferiore a 2 mm, un sopraslivellamento del tratto ST inferiore a 1 mm ed un’onda T positiva. Il tipo 3 è molto poco specifico dato che è presente anche in soggetti sani, in particolari in atleti e in soggetti giovani
| Nei casi dubbi (sospetto pattern di Brugada di tipo 2 o 3), è raccomandata l’esecuzione di un test provocativo farmacologico (Ajmalina), per slatentizzare un eventuale pattern di tipo 1 e arrivare quindi alla diagnosi di BrS. |
Recentemente è stato anche segnalato come fattore di rischio aggiuntivo la presenza di anomalie nelle derivazioni periferiche o laterali (particolarmente aVR).
Nella Sindrome di Brugada sono stati poi descritti anche altri disturbi di conduzione quali
- blocco atrio-ventricolare (BAV) (è stato riportato che il ritardo di conduzione è sotto-hissiano e che l’intervallo H-V è prolungato nella maggior parte dei pazienti);
- disturbi di conduzione intraventricolare (sono stati descritti casi di blocco di branca destra isolato o associato a emiblocco anteriore sinistro).
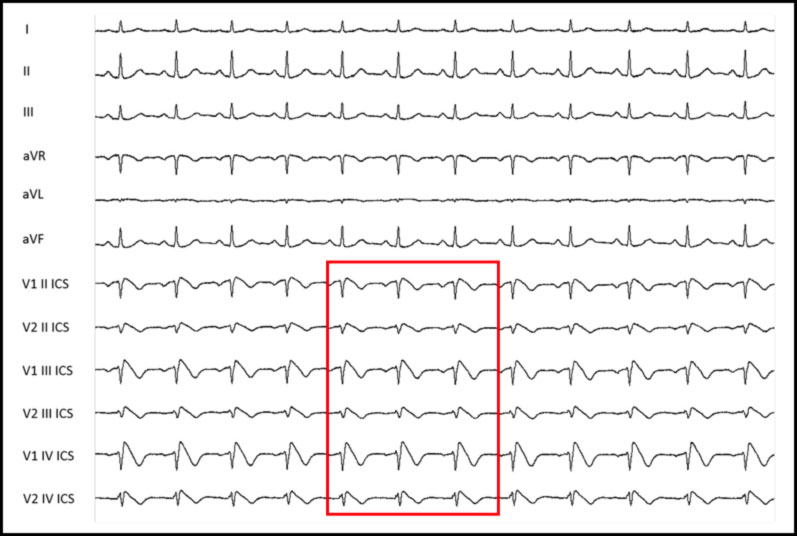
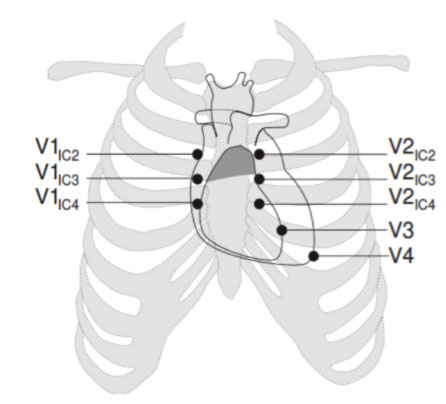
COME DEVONO ESSERE POSIZIONATI GLI ELETTRODI PER EVIDENZIARE IL PATTERN DI BRUGADA NELL’ELETTROCARDIOGRAMMA?
Per identificare la eventuale presenza di pattern di Tipo 1 spontaneo, può essere necessario posizionare le derivazioni precordiali nel 2° e 3° spazio intercostale invece che nel classico 4° spazio intercostale, le cosiddette derivazioni precordiali alte.
Questo permette di aumentare la possibilità di individuare l’anomalia elettrocardiografica tipica e quindi di fare diagnosi di BrS. Questo accade perché il fenomeno di Brugada, in condizioni basali, occorre in una porzione molto limitata della regione ventricolare destra, i cui potenziali vengono rilevati solo se gli elettrodi sono posti praticamente al di sopra della regione interessata.
QUALI SONO I SINTOMI DELLA SINDROME DI BRUGADA?
Caratteristica della BrS è l’estrema variabilità della presentazione clinica.
Purtroppo, in una considerevole percentuale di pazienti, la prima manifestazione clinica della malattia è la morte improvvisa, dovuta ad aritmie ventricolari fatali. Quest’ultimo evento catastrofico sottolinea la difficoltà di gestione della malattia nel prevedere quali saranno gli individui a maggior rischio, poiché prima di tale evento, la stragrande maggioranza dei pazienti non presenta alcun sintomo premonitore.
I pazienti affetti possono anche essere totalmente asintomatici oppure manifestare sintomi a dovuti alle aritmie cardiache, con episodi di sincope (ovvero perdita di coscienza), episodi di palpitazioni o cardiopalmo. Talvolta i pazienti possono avere convulsioni e sintomi che possono essere confusi con epilessia. I sintomi si manifestano spesso a riposo, nella fase di recupero dall’esercizio o durante il sonno notturno.
COME SI EFFETTUA LA DIAGNOSI DELLA SINDROME DI BRUGADA?
Determinante per questa sindrome è una diagnosi tempestiva, dato che il paziente affetto potrebbe essere a rischio di aritmie potenzialmente fatali. Quando è stato posto il sospetto di sindrome di Brugada, a seguito della storia clinica e familiare e del tracciato elettrocardiografico, vengono in genere eseguiti altri accertamenti cardiologici tra cui ecocardiogramma (per escludere la presenza di eventuale cardiopatia).
La presenza di un pattern di tipo 1 spontaneo è possibile porre direttamente la diagnosi di sindrome di Brugada.
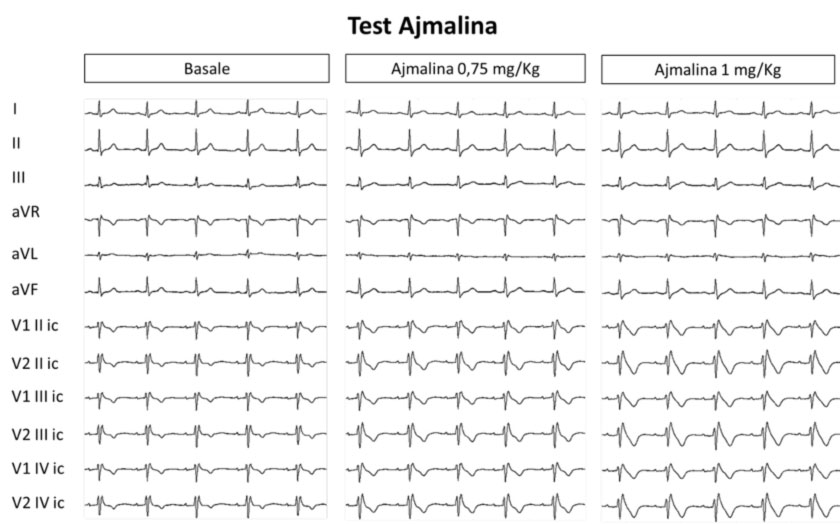
Tuttavia nella maggior parte dei casi il pattern ECG è sospetto, ma non diagnostico (pattern di tipo 2 o 3), e potrebbe essere necessario ricorrere a un test farmacologico con Ajmalina, che nei soggetti predisposti induce la comparsa del pattern di Brugada tipo 1, e quindi permette di escludere o di confermare la diagnosi di Sindrome di Brugada.
Nel caso di positività del test farmacologico, potrebbe essere necessario eseguire uno studio elettrofisiologico endocavitario (SEE), al fine di verificare l’eventuale vulnerabilità di un paziente alle aritmie ventricolari potenzialmente maligne.
CHE COS’E’ IL TEST FARMACOLOGICO PER LA SINDROME DI BRUGADA?
Il test provocativo farmacologico “test all’Ajmalina”, consiste nella somministrazione di un farmaco bloccante i canali del sodio (ajmalina), che permette di slatentizzare il pattern Brugada di tipo 1 nei casi in cui le anomalie elettrocardiografiche non siano già diagnostiche per la BrS.
Infatti, tale test provocativo è utile nei pazienti con pattern ECG tipo 2 e 3. In questi casi il test è positivo (diagnostico) quando il farmaco induce una trasformazione del pattern ECG nel tipo 1. Nei pazienti con pattern di tipo 1 spontaneo il test di routine non è raccomandato.
Il test provocativo farmacologico non ha la finalità di provocare aritmie, ma in casi particolarmente ad alto rischio, aritmie ventricolari potrebbero insorgere. Pertanto il test provocativo farmacologico viene effettuato in ambiente idoneo e in presenza di personale preparato a fronteggiare l’insorgenza di aritmie.
Se vuoi saperne di più sui > test provocativi farmacologici
A CHE COSA SERVE LO STUDIO ELETROFISIOLOGICO ENDOCAVITARIO (SEE)?
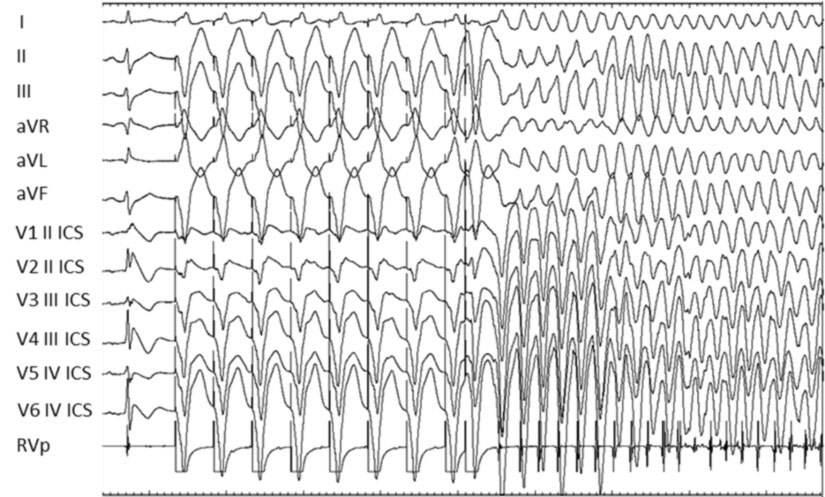
Lo studio elettrofisiologico endocavitario (SEE), attraverso la stimolazione ventricolare programmata serve a verificare la inducibilità di aritmie ventricolari, ossia la predisposizione di un certo paziente a sviluppare aritmie potenzialmente fatali.
Poiché i pazienti con sindrome di Brugada sono a rischio di morte improvvisa, lo SEE viene effettuato nei soggetti affetti dalla sindrome al fine di poter riconoscere i pazienti a rischio di sviluppare spontaneamente aritmie ventricolari.
Allo stato attuale il SEE è comunque uno dei pochi test utili disponibili per una adeguata stratificazione del rischio nel singolo paziente, specie in assenza di una sintomatologia caratteristica o una familiarità per morte improvvisa, al fine inoltre di guidare la scelta della strategia terapeutica più opportuna.
QUALI FARMACI SONO DA EVITARE NELLA SINDROME DI BRUGADA?
Molti farmaci cardiaci o non cardiaci possono provocare la comparsa o amplificare il pattern di Brugada tipo 1 nei soggetti affetti. La lista completa dei farmaci da evitare può essere scaricata qui oppure al sito www.brugadadrugs.org.
In particolare la somministrazione di farmaci antiaritmici bloccante i canali del sodio (specificamente Ajmalina e Flecainide o Propafenone, etc.), che possono venire utilizzati anche come Test provocativi farmacologici per confermare la diagnosi della malattia.
E’ da notare che in alcuni pazienti la diagnosi di Brugada viene effettuata in modo occasionale a seguito della somministrazione di flecainide o propafenone per aritmie atriali, in particolare per fibrillazione atriale, pertanto in generale è raccomandato effettuare sempre un ECG 12 derivazioni modificate prima e dopo l’inizio della terapia con farmaci antiaritmici di classe 1.
LE SOSTANZE STUPEFACENTI SONO PERICOLOSE NELLA SINDROME DI BRUGADA?
| Nei pazienti affetti da sindrome di Brugada è importante evitare abuso di alcol, fumo e droghe (in particolare cocaina), che possono indurre l’insorgenza di aritmie ventricolari potenzialmente fatali. |
QUALI SONO LE ARITMIE PIU’ FREQUENTI NELLA SINDROME DI BRUGADA?
La morte improvvisa legata all’insorgenza di aritmie ventricolari maligne può rappresentare purtroppo la prima manifestazione clinica della Sindrome di Brugada. Tra queste aritmie, quella più frequente è la tachicardia ventricolare polimorfa che degenera in fibrillazione ventricolare e quindi determina l’arresto cardiaco. Tali aritmie ventricolari possono essere innescate da battiti ectopici ventricolari, ovvero extrasistoli ventricolari.
Infatti, frequentemente i pazienti affetti da BrS, possono presentare extrasistole ventricolari che originano dalla porzione di ventricolo destro che è interessata dall’aritmia, sede del substrato aritmico della malattia.
Tuttavia, l’ampio spettro di anomalie legate alla sindrome di Brugada è associato in una non irrisoria percentuale di casi a bradiaritmie come blocchi seno-atriali e blocchi atrio-ventricolari parossistici che possono incrementare a loro volta il rischio di morte improvvisa.
Inoltre, i pazienti affetti da BrS possono inoltre manifestare una serie di altre aritmie atriali, quali la fibrillazione atriale e le tachicardie parossistiche sopraventricolari (TPSV), che tuttavia possono incidere sulla qualità di vita. Queste aritmie, sebbene non-maligne, possono rappresentare segni premonitori di una malattia genetica, soprattutto se occorrono in giovane età in soggetti senza malattia strutturale cardiaca. Pertanto, in casi specifici, è necessaria una valutazione specialistica accurata al fine di escludere una possibile BrS.
QUALI SONO I TRATTAMENTI RACCOMANDATI NELLA SINDROME DI BRUGADA?
Una volta effettuata la diagnosi di BrS, l’approccio terapeutico dipende dal livello di rischio del paziente. La Sindrome di Brugada non presenta una progressione clinica definita, quindi un paziente potrebbe manifestare nuovi elementi clinici indicativi di un possibile cambiamento del livello di rischio. Pertanto è opportuno eseguire controlli seriati semestrali. Pertanto, in questo contesto è necessario eseguire i controlli cardiologici seriati, per verificare se emergono nuovi parametri di rischio aritmico.
Attualmente le opzioni terapeutiche disponibili per la Sindrome di Brugada sono essenzialmente di tre tipi:
- Impianto di defibrillatore cardiaco (ICD, intracavitario o sottocutaneo) od di monitor cardiaci impiantabili (ICM sottocutanei o loop recorder)
- Ablazione epicardica transcatetere del substrato aritmico
- Terapia farmacologica con farmaci antiaritmici specifici (Chinidina)
Nel nostro Centro abbiamo sviluppato un approccio basato sulle caratteristiche cliniche di ogni individuo, nato dalla nostra ampia e lunga esperienza clinica pluriennale con migliaia di casi seguiti con un lungo follow-up.
QUANDO EFFETTUARE L’IMPIANTO DI DEFIBRILLATORE CARDIACO (ICD) E DI MONITOR CARDIACI (ICM) NELLA SINDROME DI BRUGADA?
L’ICD è l’unica terapia di provata efficacia in prevenzione della morte cardiaca improvvisa aritmica.
L’impianto di un defibrillatore si rende necessario in caso di un riscontro di BrS che presenti caratteristiche di alto rischio. La stratificazione del rischio si basa su di una valutazione di una serie di parametri clinici oggettivi (parametri elettrocardiografici, non-invasivi, clinici e derivanti dallo studio elettrofisiologico) insieme alla presenza di sintomi attribuibili ad aritmie potenzialmente letali.
Vista la possibile presenza di aritmie sopraventricolari o disturbi della condizione, viene in genere preferito l’utilizzo del defibrillatore intracavitario, anche se nei soggetti più giovani, o nei pazienti che hanno avuto problemi legati al defibrillatore intracavitario si può optare per l’impianto di un defibrillatore sottocutaneo.
E’ sempre necessario un approccio che si basi su multipli parametri al fine di poter ottimizzare le scelte terapeutiche più appropriate, in base alle necessità cliniche di ogni singolo paziente. Infatti ognuna di queste scelte si basa sulla valutazione del rischio di sviluppare aritmie potenzialmente fatali, e questa si effettua sia nella popolazione adulta che pediatrica. In quest’ultimo contesto, nei casi più gravi e di maggior rischio è possibile impiantare un defibrillatore. Invece, in condizioni di rischio apparente minore, è possibile offrire l’impianto di un monitor cardiaco sottopelle (implantable cardiac monitor ICM o meglio noto come loop recorder) che registra costantemente l’elettrocardiogramma. Quest’ultimo offre la possibilità di monitorare per molti anni i pazienti al fine di documentare eventuali aritmie che possano modificare la valutazione del rischio aritmico nel tempo, e pertanto modificare la strategia terapeutica se indicato.
Ognuno di questi dispositivi, ICD o ICM, sono disponibili in associazione a tecnologia di monitoraggio a distanza, meglio noto come home monitoring. Questa tecnologia consente di monitorare il funzionamento di questi dispositivi a distanza, mentre il paziente si trova a casa. Un modem in connessione wireless registra le informazioni del dispositivo impiantato e le invia su un sito internet sicuro, il cui accesso è consentito soltanto ai medici. In tal modo, i medici possono controllare non solo il corretto funzionamento dell’apparecchio, ma anche l’insorgenza di eventuali aritmie, in modo da poter intervenire tempestivamente con le strategie terapeutiche più appropriate.
QUANDO EFFETTUARE L’ABLAZIONE EPICARDICA TRANSCATETERE DEL SUBSTRATO ARITMICO NELLA SINDROME DI BRUGADA?
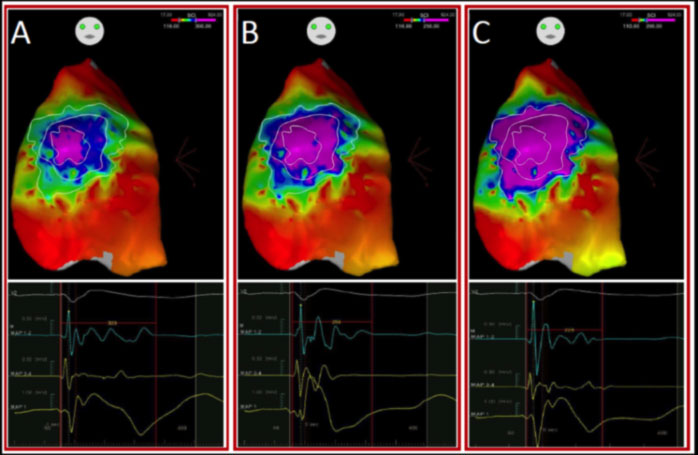
Nel 2015, il nostro gruppo guidato dal Prof. Pappone ha dimostrato che il substrato aritmogeno della Sindrome di Brugada è localizzato preferenzialmente nella regione epicardica del tratto di efflusso e della parete anteriore del ventricolo destro. Tali aree sono caratterizzate dalla presenza di potenziali elettrici anomali che possono dare origine a quelle aritmie in grado di innescare l’arresto cardiaco nei pazienti affetti da BrS.
Una volta individuato con precisione il substrato aritmogeno epicardico, sempre il nostro gruppo ha dimostrato che l’ablazione epicardica mediante radiofrequenza è in grado di eliminare tutte le anomalie elettriche e questo comporta l’immediata scomparsa del pattern elettrocardiografico della sindrome di Brugada e l’assenza di aritmie ventricolari nel follow-up.
Tale procedura è stata proposta e sviluppata nel nostro Centro, che rappresenta il Centro al mondo con la maggior esperienza per questo tipo di intervento.
Nel nostro Centro è attualmente in corso uno studio prospettico per valutare l’efficacia e la sicurezza di questo tipo di intervento.
Attualmente più di 600 pazienti affetti da Sindrome di Brugada sono stati sottoposti ad ablazione, con una incidenza di complicazioni perioperatorie estremamente basse.
La strategia ablativa proposta dal nostro gruppo può essere applicata in modo sicuro ed efficace a un numero maggiore di pazienti affetti da sindrome di Brugada considerati a rischio.
Questa esperienza rappresenta la maggiore casistica al mondo di pazienti con BrS trattati mediante ablazione e questo stabilisce il primo passo per una nuova strategia di trattamento della BrS a disposizione dei pazienti affetti.
QUANDO EFFETTUARE LA TERAPIA FARMACOLOGICA CON CHINIDINA NELLA SINDROME DI BRUGADA?
La terapia farmacologica con la Chinidina, sebbene efficace in termini generali, è gravata da numerosi effetti collaterali che ne impediscono un utilizzo prolungato e continuo. Questo fa si che tale terapia non possa essere in alcun modo sostitutiva alle sopracitate terapie e pertanto viene riservata soltanto a coloro i quali continuano ad avere recidive aritmiche. Tuttavia è stato ampiamente dimostrato che quest’ultima categoria di pazienti si giova della terapia ablativa a fronte di una terapia farmacologica cronica.
HO LA SINDROME DI BRUGADA, ESISTONO DELLE PRECAUZIONI PARTICOLARI CHE DEVO PRENDERE IN CASO DI INFEZIONE COVID-19?
Il legame tra iperpiressia (ovvero febbre) e l’insorgenza di pattern di Brugada tipo 1 e le aritmie cardiache è noto da anni. Pertanto i pazienti affetti da sindrome di Brugada (sia con pattern di tipo 1° spontaneo, che inducibile da farmaci) sono particolarmente a rischio di aritmie fatali se la temperatura corporea supera i 37.5°C. Questi pazienti devono pertanto trattare la febbre in maniera aggressiva con l’uso di paracetamolo e spugnature tiepide/fredde.
L’aumento della temperatura corporea infatti potrebbe causare una ulteriore inattivazione dei canali del sodio in pazienti con predisposizione genetica, riducendo il flusso degli ioni sodio, e favorendo l’insorgenza di aritmie, potenzialmente anche gravi in questi pazienti.
In caso di infezione COVID-19, altri fattori oltre la febbre potrebbero favorire la genesi di aritmie cardiache, incluso lo stress, l’utilizzo di farmaci potenzialmente proarritmici e i possibili squilibri degli elettroliti ematici.
Pertanto, nei pazienti affetti da Sindrome di Brugada con temperature particolarmente elevate (superiori a 38.5°C nonostante terapia con farmaci antipiretici tipo tachipirina), potrebbe essere indicata l’ospedalizzazione e in alcuni casi il ricovero in terapia intensiva ed in particolare, in caso di utilizzo di farmaci antivirali, è raccomandato il monitoraggio ECG prolungato.
HO LA SINDROME DI BRUGADA, POSSO EFFETTUARE LA VACCINAZIONE CONTRO IL COVID-19 ED ESISTONO DELLE PRECAUZIONI PARTICOLARI CHE DEVO PRENDERE IN CASO DI VACCINAZIONE ANTI COVID-19?
Non ci sono dati specifici che riguardano l’utilizzo del vaccino anti COVID-19 in pazienti con Sindrome di Brugada. Visto i rischi collegati all’infezione di COVID-19, particolarmente nei pazienti a rischio di aritmie cardiache, in generale consigliamo ai pazienti affetti da Sindrome di Brugada, anche nei giovani, di effettuare la vaccinazione profilattica.
Per quanto riguarda la tipologia del vaccino, dato che molti dei pazienti affetti sono di età giovanile, è comunque preferibile l’utilizzo di vaccini anti m-RNA. In ogni caso raccomandiamo l’utilizzo di farmaci antipiretici nel caso si manifesti un rialzo della temperatura corporea post-vaccinale (con tachipirina in caso di rialzo febbrile maggiore di 37.5°C).
In caso di pazienti di Brugada con specifiche comorbidità (ad esempio patologie oncologiche, neurologiche, autoimmuni o ematologiche, acute o croniche), naturalmente la decisione di effettuare la vaccinazione anti COVID-19 va presa caso per caso, dopo un’attenta valutazione individuale del rapporto rischio-beneficio.
