Ablazione Fibrillazione Atriale (FA)
Indice dell'articolo
Qual è lo stato dell’arte della ablazione della fibrillazione atriale?
Lo scarso successo della terapia farmacologica per la fibrillazione atriale (FA) ha incoraggiato molti ricercatori a esplorare strategie alternative (1-9). Recenti studi randomizzati hanno dimostrato che la strategia ablativa è superiore alla terapia con farmaci antiaritmici in pazienti con FA parossistica / persistente (10-12) e più di recente anche in pazienti con FA permanente o cronica (13). Tuttavia che questa superiorità si traduca in un reale beneficio in termini di morbilità e mortalità deve ancora essere dimostrato. Negli ultimi anni il numero delle procedure di ablazione di FA è cresciuto in tutto il mondo con tempi di procedura sempre più brevi, permettendo così l’inclusione di pazienti con patologie cardiache strutturale e con FA di lunga data/permanente. A causa delle ottime percentuali di successo riportate dai gruppi pionieristici e dalla attraente possibilità di una cura definitiva per la FA, molti pazienti hanno iniziato a ricercare questo approccio curativo cosi’ come molti elettrofisiologi e centri lo offrono in accordo con le nuove linee guida. Nella nostra esperienza, ormai ventennale abbiamo effettuato presso il nostro Laboratorio di Elettrofisiologia più di 30.000 procedure di ablazione di FA con un totale di successo a lungo termine > 90% nei pazienti con FA parossistica / persistente e dell’70% nella FA permanente riportando una bassa incidenza di complicanze maggiori. Nonostante lo sviluppo di sempre più nuove tecnologie e strumenti, i meccanismi della FA sono molteplici e molti rimangono ancora sconosciuti. Nel 2005 abbiamo anche dimostrato per la prima volta il vantaggio della denervazione vagale in pazienti con FA parossistica che si sottoponevano all’ablazione e tali osservazioni sono ancora oggi una pietra miliare per la comprensione della fisiopatologia e del trattamento della FA.
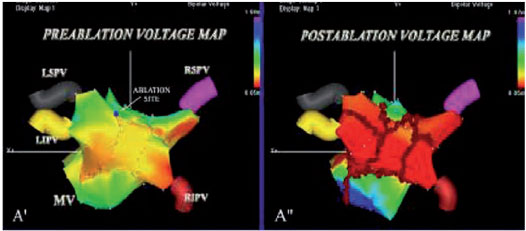
Attualmente, tuttavia, abbiamo bisogno di avere maggiori informazioni sulla fisiopatologia della FA permanente per commisurare o limitare i bersagli dell’ablazione dato che i pazienti con FA di lunga durata o permanente richiedono un’ ablazione estesa e avvolte la ripetizione della procedura. Dati del nostro laboratorio indicano che la progressione dalla forma parossistica iniziale alla forma di FA persistente o permanente è relativamente rapida e può essere prevista da variabili cliniche (14). Come risultato, l’identificazione di soggetti ad alto rischio di progressione è utile per un timing ottimale della esecuzione dell’ ablazione, evitando una procedura tardiva quando ormai la FA è divenuta permanente. Attualmente, le strategie ablative per pazienti con FA permanente e con associate patologie cardiache strutturali sono complesse, di lunga durata, meno efficaci e sono associate ad un elevato rischio di complicanze. Nel corso degli ultimi anni, altri gruppi hanno confermato i nostri precedenti risultati, anche in pazienti con FA permanente utilizzando un approccio graduale, che comprende l’aggiunta sequenziale di ulteriori bersagli dell’ablazione tramite ripetute procedure ablative così da limitare o modificare i substrati anatomici, elettrofisiologici e / o autonomici (15). Se l’ eliminazione del substrato è davvero cruciale per il risultato, la mappatura ed i sistemi di navigazione dovrebbero essere in grado di visualizzare con esattezza la complessità dell’ anatomia dell’atrio sinistro al fine di collocare con precisione le lesioni evitando inutili e pericolose applicazioni della RF (radiofrequenza) compensando eventuali imprecisioni (Figura 1).
Quali sono i criteri di selezione dei pazienti per la procedura ablativa di fibrillazione atriale?
Negli ultimi anni, le indicazioni all’ablazione della FA tramite CPVA si sono ampiamente estese, in base ai risultati di numerosi trials clinici La procedura è indicata in primis in pazienti sintomatici con fibrillazione atriale refrattaria alla terapia farmacologica antiaritmica. Attualmente la procedura è consigliata in una fase precoce della malattia, indipendente mente alla refrattarietà ai farmaci antiaritmici. Negli ultimi anni l’indicazione si è anche estesa a pazienti con scompenso cardiaco e valvulopatie, e anche in soggetti in età più avanzata, in soggetti con FA permanente e/o protesi valvolari meccaniche mitralica o aortica. Una bassa frazione d’eiezione del ventricolo sinistro non rappresenta più una controindicazione assoluta alla CPVA, anzi studi come il CASTLE-AF hanno evidenziato che anche questi pazienti beneficiano della ablazione. Recenti studi hanno evidenziato l’utilità di continuare la terapia antiaritmica dopo l’ablazione, pertanto la terapia con farmaci antiaritmci viene in genere proseguita dopo l’ablazione, e i dosaggi vengono in genere progressivamente ridotti. Anche la terapia anticoagulante viene in genere proseguita dopo l’ablazione, e viene sospesa caso per caso in funzione del burden di FA dopo l’ablazione.
In che cosa consiste l’ablazione circumferenziale della vene polmonari (o CPVA)?
Attualmente l’ablazione circumferenziale della vene polmonari (o CPVA) è la procedura standard effettuata presso il nostro laboratorio di Elettrofisiologia. La procedura viene eseguita tramite cateteri manuali o in remoto con cateteri magnetici morbidi con tempi più rapidi rispetto ad altri approcci (16). La CPVA è costituita da grandi linee circumferenziali di lesione eseguite punto per punto tali da consentire la disconnessione di tutte le vene polmonari (PV), la denervazione vagale e la non inducibilità sia di FA che di tachicardia atriale (AT) alla fine della procedura. I dati accumulati dal nostro laboratorio indicano che nei pazienti con FA parossistica / persistente senza ingrandimento atriale la CPVA da sola è associata ad ottimi risultati, mentre nei pazienti con FA di lunga durata / persistente o permanente e con atri dilatati ulteriori lesioni lineari sono necessarie per raggiungere la non inducibilità di aritmie.
Preparazione pre-procedura
L’ecocardiogramma transesofageo (TEE) rappresenta l’esame di scelta per escludere la presenza di trombi in atrio sinistro o in auricola, i quali sono considerati una controindicazione assoluta alla procedura ablativa che viene rinviata sino a che la presenza di trombi cardiaci viene esclusa da un nuovo TEE durante terapia anticoagulante (sia con farmaci DOAC che Dicumarolici). Alla dimissione, si esegue abitualmente un ecocardiogramma transtoracico. Tre giorni prima della procedura, i pazienti che assumono terapia anticoagulante orale la interrompono. La notte prima dell’ablazione, si inizia l’infusione di eparina per raggiungere valori di ACT tra 200 e 250 secondi; l’eparina viene interrotta solo 2 ore prima della procedura per eseguire in modo sicuro la puntura transettale. Come sedazione, si utilizza anche una dose di infusione peso-dipendente di narcotico, come remifentanil (0,025-0,05 mcg/kg/minuto). La cardiochirurgia è prontamente accessibile per eseguire procedure di emergenza chirurgica quando necessario. Un’ecocardiografia al letto del paziente in laboratorio di elettrofisiologia è disponibile in primo luogo per la diagnosi di tamponamento pericardico.
Obiettivi della CPVA
Lo scopo dell’ ablazione transcatetere è l’eliminazione del trigger e la modifica del substrato mediante la minor quantità di lesioni possibile. Il ripristino del ritmo sinusale stabile e la non inducibilità a fine procedura sia di FA che di TA è il gold standard della CPVA. Tuttavia, molti pazienti con FA di lunga durata /permanente dopo il conseguimento del ritmo sinusale al termine della procedura, sono ancora suscettibili di inducibilità di FA/TA sostenute che richiedendo ulteriori lesioni lineari nell’atrio sinistro (LA) per raggiungere la non inducibilità. Gli end point della procedura di CPVA standard includono la disconnessione elettrica delle PV, la denervazione vagale, linee di lesione posteriori e la linea dell’istmo mitralico; ulteriori lesioni lineari, tra cui la disconnessione del seno coronarico (CS), sono gli ultimi bersagli. Gli obiettivi vengono ottenuti con un unico catetere mappatore/ablatore. Allo stato attuale, non usiamo la tecnologia con pallocino dato che il nostro approccio non si limita solamente alla disconnessione delle PV e dato che il raggiungimento di multipli obiettivi preclude il suo uso. Inoltre, la PV hanno anatomie largamente variabili da paziente a paziente, con una vasta gamma di diametri e la frequente presenza di osti comuni in oltre il 30% dei pazienti rendono difficile l’uso di questa tecnologia.
Disconnessione delle vene polmonari
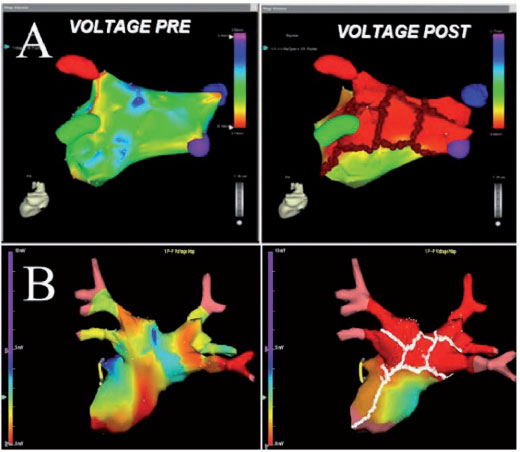
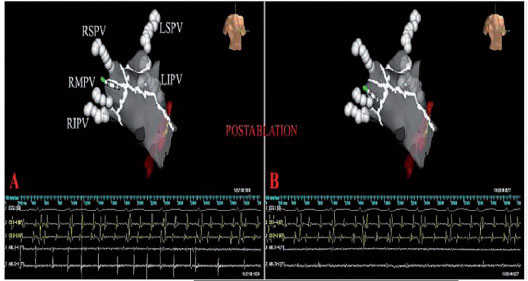
Le linee circonferenziali sono localizzate nel tessuto atriale al di fuori del ostio delle PV, una zona spesso denominata antro (Figura 1). Le lesioni sono disegnate per circondare le PV di destra e di sinistra singolarmente o in coppia. La convalida dell’ isolamento elettrico con il catetere per la mappatura circolare non viene eseguito nel nostro laboratorio dal momento che abbiamo eseguito un vero e proprio isolamento elettrico distale attraverso l’abbattimento dei potenziali riduzione (riduzione > 90% dell’ampiezza dell’elettrogramma), anche all’interno delle aree circondate (ampiezza dell’elettrogramma < 0.1 mV). La disconnessione delle PV viene ottenuta con la stabilità ottimale del catetere e il contatto con la parete che residua in una rapida attenuazione degli elettrogrammi atriali durante ogni erogazione di RF fino alla loro completa eliminazione (Figura 2).
Segnali in zone parzialmente ablate richiedono ulteriori applicazioni di RF prima di passare al successivo sito di ablazione.
Obiettivi autonomici della denervazione vagale
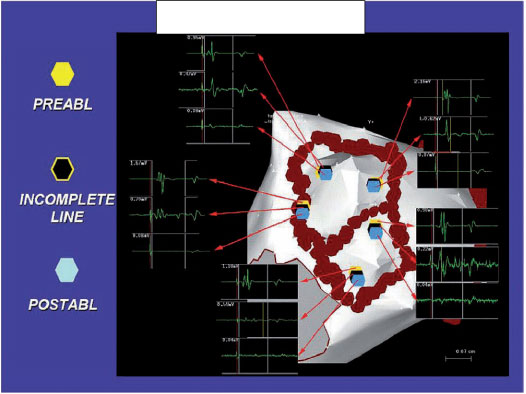
Quando possibile, l’eliminazione dei riflessi vagali in siti di innervazione nel corso della procedura rappresenta uno degli obiettivi più importanti dato che la denervazione vagale è un forte elemento predittore per il successo a lungo termine della procedura ablativa (Figura 3). Per prima cosa abbiamo dimostrato che la CPVA induce una denervazione vagale non a lungo termine, ma transitoria che comunque ne incrementa l’efficacia a lungo termine (8). Questi risultati sono stati confermati da molti altri autori con diversi approcci ablativi ed ora la denervazione vagale costituisce una nuova affascinante strategia per l’ablazione della FA. I nostri risultati sulle modificazioni della HRV dopo ablazione aggiungono nuove intuizioni per la comprensione dei meccanismi della FA e del suo trattamento. Mentre si praticano le lesioni standard della CPVA, le erogazioni di RF evocano riflessi vagali in circa 30% dei pazienti. Vanno annoverati come riflessi vagali la bradicardia sinusale (FC<40 battiti al minuto. bpm), l’asistolia, il blocco AV e l’ipotensione che si verificano entro pochi secondi dall’inizio dell’ applicazione della RF (Figura 3).
Se viene evocato un riflesso di questo tipo l’energia a RF viene fornita fino a quando tali riflessi vengono aboliti, o fino ad un massimo di 30 secondi. Lo scopo dell’ ablazione in questi siti è la cessazione del riflesso, seguito da tachicardia sinusale o FA. La mancata riproduzione dei riflessi con ripetute applicazioni di RF è considerato una conferma della denervazione. In base alla nostra esperienza, abbiamo sempre tentato di stimolare e quindi ablare tali siti per denervazione vagale. Abbiamo riportato una ”mappa autonomica” dettagliata del LA come obiettivo dell’ ablazione dimostrando che come la vena polmonare superiore sinistra anche la regione settale è riccamente innervata (8).
Ablazione della linea posteriore e dell’istmo mitralico
Nella procedura standard di CPVA vengono praticate linee di ablazione supplementari lungo la parete posteriore ed il tetto del LA tra le due serie di lesioni che collegano le PV superiori ed inferiori e l’annulus mitralico (Figura 1). La linea dell’istmo mitralico viene utilizzata per prevenire la tachicardia atriale macrorientrante postablazione (5,16,17) e per ridurre ulteriormente il substrato aritmico (Figura 3). La completezza della linea dell’istmo mitralico è un importante obiettivo elettrofisiologico e viene convalidata durante la stimolazione epicardica dal seno coronarico (CS) e durante la mappatura del seno coronarico, in cerca di potenziali doppi lungo la linea di blocco, e confermata dal pacing differenziale (5). Il minimo intervallo tra doppi potenziali nell’istmo mitralico durante il pacing da CS dopo blocco è di 150 ms, ciò dipende dalle dimensioni atriali e dall’estensione delle cicatrici e delle lesioni (5).
Ablazione dell’ istmo cavo-tricuspidalico
I pazienti con FA e storia di flutter atriale comune o pazienti con FA permanente vengono sottoposti ad ablazione dell’istmo cavo-tricuspidalico. Se tutti gli endpoint vengono raggiunti alla fine della CPVA standard ed il paziente è in ritmo sinusale, la non inducibilità di FA / TA è l’obiettivo finale.
Lesioni lineari addizionali e disconnessione del seno coronarico
Se l’inducibilità della FA e della TA persiste anche dopo la cardioversione, rivediamo accuratamente le linee di lesione e le aree ablate per verificare potenziali residui e applicare radiofrequenza quando serve. Se necessario, vengono eseguite delle linee di ablazione aggiuntive (di solito tetto, setto o la base del LA) prima dell’isolamento del CS, che è l’ultimo obiettivo (Figura 4).
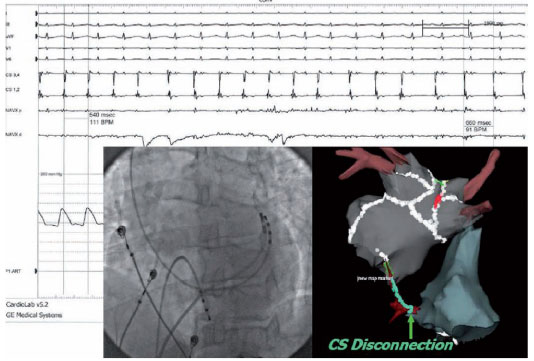
La compartimentalizzazione viene valutata dalla presenza di un “corridoio” di potenziali doppi e dalla dimostrazione di attivazione verso la linea del blocco da entrambi i lati. Una completa linea del tetto del LA può essere dimostrata dall’attivazione progressiva in senso caudocraniale sulla parete posteriore durante stimolazione dalla LAA. L’attività dalla muscolatura atriale a livello del CS può essere un conduttore per la FA di lunga durata o permanente. La disconnessione elettrica del seno coronarico dall’atrio viene eseguita con l’ablazione a livello endocardico o epicardico (o entrambi). L’eliminazione totale dell’ attività elettrica del seno coronarico è l’obiettivo ideale, ma l’organizzazione dell’attività elettrica del CS e/o il rallentamento della frequenza locale con dissociazione fra il potenziale di attività del CS e del LA viene considerato pure come prova di isolamento del CS. Siti del CS endocardici e/o epicardici sono frequenti target di ablazione nei pazienti con FA permanente ed atrii dilatati.
Rimappaggio post-ablazione
Una volta che è stata ottenuta la non inducibilità della FA/TA, l’atrio sinistro (LA) viene nuovamente mappato, e le mappe preablazione e post-ablazione di attivazione vengono confrontate (Figura 1). Nei pazienti in ritmo sinusale, la rimappatura postablazione del LA viene fatta usando la mappa pre-ablazione per l’acquisizione di nuovi punti per confrontare le mappe di voltaggio bipolari pre e post ablazione. Nei pazienti in FA, dopo il ripristino del ritmo sinusale, il mappaggio post-ablazione è effettuato utilizzando la mappa anatomica acquisita durante la FA per convalidare l’accuratezza delle lesioni. Il blocco incompleto viene rivelato dalla propagazione dell’impulso in tutta la linea ablativa e richiede ulteriori applicazioni di RF per il completamento della linea ablativa nonostante la non-inducibilità.
La puntura transettale
Solitamente, prima della puntura transettale, un catetere viene inserito nel seno coronarico per mappare l’attività atriale sinistra, e un catetere multipolare viene posizionato nell’atrio destro per mappare l’attività elettrica dell’atrio destro. La CPVA richiede una singola puntura transettale per il catetere di mappaggio/ablazione. Dopo l’accesso transettale viene somministrato un singolo bolo di eparina per via endovenosa e vengono prelevati 2 campioni di sangue ogni 15 minuti per controllare l’ACT che deve essere mantenuto > 250 s o più.
Individuazione dei target di ablazione
E’ necessaria un’accurata identificazione dei bersagli e una procedura di ablazione di durata relativamente breve per evitare complicanze maggiori e raggiungere con successo tutti gli obiettivi. Attualmente, ciò viene facilitato dall’uso della navigazione 3-D e di sistemi di mappaggio che forniscono un orientamento preciso dal punto di vista anatomico ed elettrofisiologico. La CPVA viene eseguita in 1 ora circa, ma può essere più lunga (sino a 3 ore) in pazienti con FA permanente con atri dilatati, per raggiungere tutti gli obiettivi tra cui la disconnessione del CS e la non inducibilità della FA/TA.
Il mappaggio elettroanatomico
Abitualmente nel nostro laboratorio di Elettrofisiologia utilizziamo i sistemi di mappaggio CARTO (BiosenseWebster, Diamond Bar, CA, USA) e l’EnSiteNavX (St. Jude Medical, St. Paul, MN, USA), che hanno notevolmente accorciato il tempo di fluoroscopia migliorando il profilo di sicurezza della procedura (figura 1). La precoce adozione da parte del nostro gruppo del sistema di mappaggio CARTO, ha permesso una ricostruzione accurata della complessa anatomia atriale sinistra ed ormai viene accettata dall’intera comunità di elettrofisiologia che esegue l’ablazione di FA (2). Il sistema CARTO localizza in continuo la posizione del catetere utilizzando tre campi magnetici molto bassi, mentre il sistema NavX è basato su campi elettrici generati da tre coppie di elettrodi cutanei ortogonali in 3 assi X, Y,e Z. (Figura 1). A differenza del CARTO, il nuovo NavX consente di ottenere una ricostruzione 3-D sia della punta e che del corpo del catetere, che è particolarmente utile in aree “difficili” come gli osti delle PV, la cresta, l’anulus mitralico e l’area settale. Il monitoraggio del catetere con il sistema NavX viene ottenuto da un indicatore di vicinanza che, sulla base dell’intensità del colore della punta del catetere permette all’operatore di controllare il contatto ottimale del catetere di ablazione, contatto che quando associato all’abbattimento del potenziale atriale indica il conseguimento dell’obiettivo (Figura 1).
Durante le applicazioni della RF il movimento cardiaco, il dolore e la respirazione sono tutti fattori che influiscono sulla stabilità del posizionamento del catetere, ma il software NavX consente di ridurre al minimo l’entità del movimento dei bersagli, nonché gli artefatti respiratori. Quando viene ablata la parete posteriore, che è una zona vulnerabile a maggior rischio di perforazione cardiaca, la presenza di dolore può causare modificazioni della frequenza respiratoria e la compensazione respiratoria da parte del NavX è utile per il mantenimento della stabilità del catetere. Inoltre, la tecnologia Navx è in grado di creare separatamente qualsiasi anatomia desiderata per ogni target dell’ablazione che si traduce in una più accurata ablazione in particolar modo di target difficoltosi come l’ostio delle PV, il loro antro, la parete posteriore, e il CS (figure 4 e 5).
Sebbene il sistema NavX Ensite consenta di raccogliere rapidamente e sequenzialmente molti punti, nelle aree difficili si preferisce acquisire i punti manualmente come nel sistema CARTO. Un altro importante vantaggio del sistema NavX rispetto al CARTO è che i movimenti del paziente durante la procedura non inficiano la ricostruzione della mappa, in quanto il catetere di riferimento si muove anche per la presenza di patch attaccati al corpo del paziente. Come per il sistema CARTO, dopo l’ablazione una mappa di voltaggio viene mostrata tramite un gradiente colorimetrico per verificare il completo abbattimento dei potenziali lungo le linee di lesione e al loro interno (Figura 1). Attualmente, con entrambi i sistemi elettroanatomici in pochi minuti siamo in grado di ricostruire l’anatomia del LA ed i target di ablazione. La ricostruzione delle PV e dei loro osti rappresenta il primo passo e viene confermata dall’uso simultaneo di fluoroscopia, elettrogrammi e gradienti di impedenza. Tipicamente e contemporaneamente, una volta che il catetere entra nella PV, la punta viene vista al di fuori dell’ombra cardiaca su fluoroscopia, i valori di impedenza significativamente aumentano (oltre 4 Ohm al di sopra dell’impedenza atriale sinistra), e gli elettrogrammi atriali scompaiono. Una volta che le PV vengono visualizzate, una ricostruzione sequenziale dettagliata dell’atrio sinistro viene eseguita comprese le pareti posteriori e anteriori, la LAA, il tetto, il setto e l’anulus mitralico con il suo istmo. Il setto e il canale tra LAA e il LSPV spesso richiedono l’acquisizione di molti punti in più rispetto ad altre zone. La LAA, che si identifica con la presenza di elettrogrammi atriali non frazionati e di grande ampiezza e ampi elettrogrammi ventricolari con un’attività elettrica organizzata in FA, rappresenta una delle ultime aree che viene mappata. Il canale tra LAA e LSPV e mostra potenziali che tipicamente sono più piccoli di quelli della LAA ma più alto e più frazionati che nel resto dell’atrio sinistro. Se il canale non viene ricostruito con precisione, il lato sinistro della lesione circumferenziale può essere posizionato troppo vicino al LAA o all’interno dell’ostio delle PV, fatti che possono determinare una scarsa efficacia e complicanze maggiori, come la perforazione della LAA e la stenosi delle PV. Anche se la ricostruzione del tetto è più facile richiedendo meno punti da acquisire, una non corretta interpolazione dovrebbe essere evitata quando si utilizza il sistema CARTO.
Ablazione dei target desiderati
Una volta che l’atrio sinistro e le principali vene polmonari sono state adeguatamente ricostruite, viene erogata energia a radiofrequenza, che nel nostro laboratorio è il tipo di energia più frequentemente utilizzata, per l’ablazione endocardica dei sopramenzionati target elettrofisiologici ed anatomici. Negl’ultimi tre anni abbiamo utilizzato un catetere 4 mm irrigato invece del catetere 8 mm irrigato che ha dimostrato avere alcune limitazioni tra le quali la propensione alla formazione di coaguli ed una erogazione insufficiente di energia nelle aree a basso flusso ematico. Il catetere irrigato permette di distribuire adeguatamente l’energia e di ottenere delle lesioni più grandi minimizzando il rischio embolico. Nel nostro approccio , l’efficacia dell’erogazione delle radiofrequenze è e rimane importante ma cerchiamo di moderare la loro potenza nelle aree a rischio in funzione di una maggiore sicurezza. Di solito utilizziamo un più basso settaggio della potenza (30-50 W) ed un flusso di irrigazione di 2 ml/min ( durante il mappaggio) e fino a 50 ml/min durante l’ablazione ( in base al sito d’erogazione delle radiofrequenze). Per le lesioni circonferenziali, le radiofrequenze vengono erogate ad una distanza di circa 1 cm dagli osti (invece di 5 mm) riducendo in questo modo il rischio di stenosi delle vene polmonari. Se si verifica un incremento dell’impedenza (> 10 Ohms) o il paziente accusa un dolore urente, le radiofrequenze vengono interrotte immediatamente. Quando l’ablazione inizia il flusso di irrigazione aumenta da 2 a 17 ml/min mentre i valori di impedenza e di temperatura alla punta del catetere vengono costantemente monitorati. L’energia in uscita viene limitata a 50W con una temperatura massima di 48 C durante tutta la procedura, ma valori più bassi vengono utilizzati nella parete posteriore e nel seno coronarico per ridurre il rischio di lesione delle strutture adiacenti. Di solito le linee di lesione circonferenziali sono praticate cominciando dalla porzione laterale dell’anulus tricuspidalico e spostandosi posteriormente, poi anteriormente a sinistra delle vene polmonari, si supera il crinale tra la SPV e l’atrio e andando a chiudere la lesione sulla parete posteriore dell’atrio. Le vene polmonari di destra vengono isolate in un modo simile e successivamente vengono fatte posteriormente altre due linee che collegano le due linee circonferenziali. Le linee circonferenziali vengono adattate in base all’anatomia individuale della giunzione tra vena polmonare ed atrio. Una singola linea circonferenziale circonda le due VP ipsilaterali in presenza di osti distanti tra loro meno di 20 mm, in presenza di un ostio comune o di una dipartizione in branche precoce. Se anatomicamente possibile noi pratichiamo anche una linea di lesione tra i due osti per ridurre ulteriormente il substrato anatomico ed elettrofisiologico. Caratteristicamente in paziente con FA permanente ed atri dilatati, mentre effettuiamo la disconnessione del seno coronarico e prima del ripristino del ritmo sinusale, si assiste ad una regolarizzazione del ciclo con una trasformazione in TA ed una morfologia uniforme dell’onda P. Con il nostro approccio, avviene un ripristino del ritmo sinusale in pressochè la totalità dei pazienti con FA permanente. Il ripristino a RS si ha immediatamente o previa trasformazione in TA. La procedura ha successo quando tutti gli endpoints vengono raggiunti.
Ablazione delle aree critiche
L’ottenimento di tutti gli endpoint è cruciale ma può essere difficoltoso in aree specifiche. Di solito applicazioni ripetute di radiofrequente di breve durata, alta intensità e flusso di irrigazione più alte sono necessarie attorno alla VPSS dove i potenziali atriali sono più difficili da eliminare. Il completo abbattimento dei potenziali atriali nella cresta tra la VPSS e l’auricola richiede applicazioni di RF più lunghe e con una potenza più elevata. Se la cresta è troppo stretta, la linea di ablazione viene fatta passando alla base dell’auricola. Le VPD e l’istmo mitralico sono altri due siti difficoltosi sia per il mappaggio che per l’ablazione e richiedono continui aggiustamenti nel setting della RF. Le linee di lesione incomplete soprattutto in prossimità dell’istmo mitralico possono residuare in gap che vanno a sostenere una tachicardia atriale post ablazione incessante. Nei pazienti portatori di protesi valvolari meccaniche il mappaggio e l’ablazione in prossimità dell’area mitralica può risultare difficoltoso; tuttavia nella nostra esperienza non si è verificato nessun caso di intrappolamento del catetere. La linea dell’istmo mitralico richiede la validazione della disconnessione con manovre di pacing e in una minoranza di paziente anche applicazioni all’interno del seno coronarico. L’ablazione dei siti di connessione tra il SC e la muscolatura atriale richiede molta attenzione e richiede dei settaggi più bassi di energia e flusso di irrigazione per evitare la perforazione ed il tamponamento cardiaco. Di solito noi pratichiamo due applicazioni di radiofrequenze a bassa energia (tra i 15 ed i 30 W) dal distale al prossimale invece che una singola applicazione per mantenere la temperatura bassa ed evitare potenziali complicanze. La parete posteriore rappresenta anche un’area potenzialmente a rischio di complicanze quali la fistola atrio-esofagea e il tamponamento cardiaco. E’ ben conosciuto che la parete posteriore non solo è la parete più sottile dell’atrio sinistro ma è in stretta correlazione con l’esofago. Pertanto quando applichiamo radiofrequenze in quest’area, utilizziamo un settaggio più basso in termini di energia e di flusso di irrigazione.
Come avviene la gestione del periodo post procedura e delle eventuali complicanze?
Alla fine della procedura di solito utilizziamo del solfato di protamina per permettere la rimozione degli introduttori. Successivamente la gestione comprende la terapia anticoagulante, mentre in passato con i dicumarolici si utilizzava l’embricazione con eparina, attualmente con i farmaci DOAC, questo non è più necessario e si prosegue il solo anticoagulante orale. La possibilità di ottimizzare i parametri di ablazione in funzione delle aree più critiche permette di avere un minor tasso di incidenza di complicanze maggiori. Il tamponamento cardiaco deve essere escluso in tutti i pazienti che hanno ipotensione nel postprocedura. Nella nostra esperienza tuttavia tale complicanza è molto rara se si presta attenzione ai settaggi utilizzati. Solo pochi pazienti hanno richiesto una pericardiocentesi a seguito del versamento pericardico e abbiamo riportato solo un caso di fistola atrioesofagea. L’insorgenza tardiva (6-10 giorni dopo l’ablazione) di uno stato febbrile con o senza sintomi neurologici dovrebbe sempre indurre al sospetto di fistola atrio esofagea che dovrebbe essere esclusa tramite una TAC spirale con contrasto. Nella nostra estesa esperienza che contempla oltre 30.000 casi di CPVA non ci sono stati decessi perioperatori, o complicanze maggiori quali stenosi delle VP, lesione del nervo frenico o occlusione delle coronarie. Le complicanze minori sono poco frequenti, mentre un versamento pericardico non emodinamicamente significativo interessa circa il 4% dei pazienti. Un dolore pericarditico può essere presente nei primi giorni della post-procedura e solitamente è responsivo ai salicilati.
Controllo del ritmo post PTCA
L’assenza di sintomatologia potrebbe non corrispondere ad un ripristino stabile del ritmo sinusale e l’accuratezza della valutazione delle ricorrenze post-ablazione il più delle volte dipende dalla durata delle registrazioni ECG. Per valutare qual è il carico delle ricorrenze asintomatiche dell’aritmia, solitamente dopo l’ablazione i pazienti vengono sottoposti a impianto di loop recorder (generalmente entro 45 giorni dall’ablazione), seguito con monitoraggio remoto. In alternativa i pazienti possono sottoporsi ad registrazioni ECG secondo Holter dopo 1,3, 6 e 12 mesi e ad un monitoraggio ECG transtelefonico (cardiotelefono)
Valutazione della efficacia ed eventuale ripetizione della procedura
Nei primi due mesi dopo la procedura è possibile che ci siano delle recidive di fibrillazione atriale, tuttavia nella metà dei casi esse costituiscono un fenomeno transitorio e non richiedono una seconda procedura. L’efficacia a lungo termine della CPVA e > 90% nei pazienti con fibrillazione atriale parossistica e di circa l’80% nei pazienti con fibrillazione atriale permanente allorquando non è stato possibile indurre FA o TA al termine della procedura. Nei pazienti con fibrillazione atriale parossistica e denervazione vagale locale il tasso di successo a lungo termine è più alto. Se c’è ricorrenza di fibrillazione atriale persistente o episodi frequenti di fibrillazione atriale sintomatica o presenza di un flutter atriale destro o sinistro sintomatico si propone una seconda procedura a distanza di almeno sei mesi dalla prima. La procedura è ripetibile per un massimo di 3 volte.
Rimodellamento atriale
La valutazione delle potenziali conseguenze dell’ablazione sulla contrattilità dell’atrio è importante per la correlazione di questa con il rischio tromboembolico. Dopo l’ablazione noi valutiamo attentamente la funzione contrattile dell’atrio sinistro sia nell’immediato periodo postprocedura sia durante il follow-up a lungo termine. Nella nostra esperienza, dopo l’ablazione i diametri i dell’atrio sinistro si riducono e la funzione contrattile migliora, ma la significatività di questi miglioramenti dipende strettamente dalle dimensioni atriali prima dell’ablazione. Nei pazienti senza recidive e con una buona funzione atriale noi interrompiamo la terapia anticoagulante.
Tachicardia atriale post ablazione
Se durante la procedura sono stati raggiunti tutti gli obiettivi, la tachicardia atriale post ablazione si sviluppa in meno del 5% dei casi, e di solito si tratta di una tachicardia da macro/micro rientro piuttosto che di una tachicardia atriale focale. Nella nostra esperienza queste tachicardie dovrebbero essere trattate inizialmente in maniera conservativa tramite terapia farmacologica o con la cardioversione. Solo nei pazienti sintomatici si ripete la procedura al fine di ottimizzare la terapia ablativa ed in molti casi si ottiene il successo terapeutico. L’ablazione dovrebbe essere eseguita non mediante lesioni empiriche ma previo riconoscimento del meccanismo sottostante. La morfologia dell’onda P, il suo asse, e la continua attivazione dell’atrio fa propendere per un meccanismo di macrorientro mentre l’osservazione di una linea isoelettrica tra le onde P fa propendere per una tachicardia focale. Di routine noi eseguiamo sia una mappa di voltaggio che di attivazione; combinandole assieme a manovre di pacing per un migliore risultato della terapia ablativa. Di solito la mappa di attivazione mostra l’attivazione più precoce e quella più tardiva con una scala cromatica che fa riferimento ad una finestra temporale pari al ciclo della tachicardia. La più comune tachicardia atriale post-ablazione è dovuta ad un macrorientro ad origine dall’anulus mitralico. L’entrainment con intervalli post-pacing pari al ciclo della tachicardia misurati in più di tre siti attorno all’anulus mitralico superiore ed inferiore, con un tempo d’attivazione attorno all’anulus tricuspidalico pari al ciclo della tachicardia depongono fortemente per la diagnosi di tachicardia atriale ad origine dall’anulus mitralico. Come nel caso del flutter atriale destro istmo-dipendente, l’area più stretta del circuito si situa tra la VPIS e l’anulus. Di conseguenza il punto migliore dove cercare i gap residui e dove ripetere l’ablazione è proprio l’istmo mitralico. Per le tachicardie atriali micro-rientranti (lunghezza del ciclo inferiore all’80%) originanti dalla riconnessione degli osti delle VVPP, l’ablazione dei siti con attivazione più precoce che hanno un entrainment occulto risulta essere molto efficace. Frequentemente le mappe di voltaggio mostrano aree di voltaggio preservato nei siti di attivazione precoce, suggerendo la presenza di aree non ablate in precedenza o ablate in maniera insufficiente. Il rientro attorno alle vene polmonari destre o sinistre può essere dimostrato mediante pacing dal seno coronarico distale e prossimale, dal setto e dal tetto dell’atrio. La loro gestione richiede l’uso di mappe d’attivazione 3-D per delineare il decorso della tachicardia e per identificare una linea di lesione che colleghi le barriere anatomiche al fine di interrompere i circuiti di tachicardia atriale. Le RF vengono erogate dopo aver ben identificato gli istmi critici con una dettagliata mappa elettroanatomica. Di solito sono necessarie solo poche applicazioni di RF per eliminare i circuiti di tachicardia e la loro inducibilità.
Quali sono i vantaggi del sistema remoto di mappaggio ed ablazione remoto con Stereotaxis?
Attualmente la maggior parte delle procedure di ablazione trans-catetere vengono eseguite manualmente in maniera tradizionale e questo richiede un personale qualificato ed esperto nella manipolazione dei cateteri e nell’erogazione di RF. In un moderno laboratorio di elettrofisiologia la presenza di sistemi di navigazione magnetica fa si che vengano limitate le differenze dovute al fattore umano e che i risultati risultino più riproducibili. La fattibilità di un sistema in remoto che non sia operatore dipendente, potrebbe rappresentare una alternativa interessante ed attraente per i laboratori che potrebbero ottenere in questo modo un tasso di successo elevato minimizzando i rischi. La recente possibilità di avere un catetere magnetico con punta irrigata aumenterà i benefici del sistema remoto di ablazione, potendo effettuare delle lesioni più profonde indipendentemente dall’esperienza dell’operatore. Abbiamo dimostrato che la navigazione in remoto potrebbe facilitare sia il mappaggio che l’ablazione indipendentemente dalla destrezza dell’elettrofisiologo. Il sistema di navigazione magnetica utilizza cateteri morbidi dotati di 3 piccoli magneti sulla punta, per un orientamento ottimale nel campo magnetico creato da due grandi magneti posizionati su entrambi i lati del tavolo operatorio. Questo sistema è formato da due componenti indipendenti che comunicano tra loro: Il Niobe Stereotaxis MNS e il sistema di mappaggio elettroanatomico CARTO-RMT. Il Niobe include una interfaccia informatica che è controllata da una tastiera e da un joystick che cambia l’orientamento dei due magneti modificando l’orientamento del campo magnetico e quindi la localizzazione e l’orientamento della punta del catetere. L’operatore sta in una stanza separata, a distanza dalla fluoroscopia e dal corpo del paziente. Questo sistema è combinato con il sistema di mappaggio CARTO che è stato modificato per supportare la navigazione magnetica. Un catetere con punta magnetica da 4-8 mm (Navistar-RMT, Biosense Webster,Inc.) può essere collegato al CARTO-RMT ed attualmente anche in Europa sono disponibili cateteri con punta irrigata. I tre magneti presenti nella porzione distale del catetere permettono al catetere ampie possibilità di orientamento dello stesso mentre il movimento è garantito da un device meccanico (Cardiodrive Stereotaxis). I vettori del campo magnetico utilizzati per ciascun target di navigazione e di ablazione possono essere memorizzati e reimpiegati per l’ablazione automatizzata. Può essere creata un’ accurata mappa elettroanatomica semplicemente utilizzando la funzione automatica presente nel software Navigant che è stata specificatamente disegnato per il mappaggio dell’atrio sinistro. C’è anche la possibilità di prendere dei punti addizionali in aree di particolare interesse. L’acquisizione sequenziali di diversi punti tutti attorno all’atrio sinistro con un contatto a parete stabile dell’elettrocatetere permette di ricreare in maniera accurata le geometrie cardiache anche nelle aree più complesse, con un sorprendente grado di accuratezza ed efficacia. Nella nostra esperienza il mappaggio e l’ablazione in remoto è stata possibile in tutti i pazienti sottoposti all’ablazione di fibrillazione atriale. Inizialmente i tempi della procedura erano un poco più lunghi rispetto alle procedure manuali e questo a causa della curva di apprendimento che nelle prime fasi richiede frequenti aggiustamenti dell’orientamento della punta del catetere. I tempi dell’ablazione per completare le linee di lesione attorno ad aree critiche come le VP di destra sono più brevi in remoto che con l’ablazione manuale, suggerendo che con la navigazione magnetica anche i siti più difficili sono comunque raggiungibili, evitando così applicazioni superflue di RF e di conseguenza riducendo complicanze maggiori.
Vantaggi del sistema remoto di navigazione
L’orientamento dell’elettrocatetere è interamente guidato dai vettori del campo magnetico ed inoltre il catetere RMT è molto più morbido dei cateteri tradizionali in prossimità del segmento distale. Se il catetere non raggiunge la localizzazione prestabilita, l’operatore deve semplicemente spostare il catetere dall’ostacolo anatomico e avanzare verso la localizzazione desiderata manipolando il campo magnetico. Questo porta ad una minore traumatismo dell’endocardio e ad un minor rischio di perforazione cardiaca. Sempre nella nostra esperienza non è stato riportato alcun caso di perforazione cardiaca durante il mappaggio delle aree dell’atrio sinistro con pareti muscolari sottili. I cateteri “soft touch” utilizzati nella navigazione magnetica portano ad una minor deformazione delle camere cardiache rispetto ai cateteri tradizionali, a vantaggio di una ricostruzione anatomica più accurata e di un minor utilizzo della fluoroscopia.
Limitazioni del sistema remoto di navigazione
Ci sono alcune limitazioni del sistema remoto di navigazione, che potranno essere risolte con l’avanzare del progresso tecnologico. La dimensione e la posizione dei magneti può interferire con la visione fluoroscopia del cuore durante la procedura. Tuttavia questo inconveniente può essere ovviato dalla presenza di una più accurata mappa elettroanatomica.
Come avviene la gestione dei farmaci anticoagulanti nei pazienti sottoposti ad ablazione?
Lo stroke è una complicanza possibile e temuta dell’ablazione dell’FA, in particolare per la possibilità di episodi ischemici pacuisintomatici in caso di FA silente. Per prevenire lo stroke o altri eventi tromboembolici, prima della procedura di ablazione nel nostro Centro di routine viene eseguito un ecocardiogramma trans-esofageo.
Terapia anticoagulante pre ablazione
Per quanto riguarda l’anticoagulazione pre-ablazione, i pazienti con fibrillazione atriale permanente e in generale tutti i pazienti ad alto rischio (pazienti con fibrillazione atriale persistente o con fibrillazione atriale parossistica associata ad altri fattori di rischio) richiedono una terapia anticoagulante orale efficace in atto (da almeno tre settimane documentate da un attento monitoraggio del valore di INR > 2 in caso di dicumarolici, da almeno 48-72 ore in caso di DOAC). In pazienti che non assumevano terapia anticoagulante perché a basso rischio, vengono comunque sottoposti a terapia anticoagulante con DOAC con nei giorni immediatamente precedenti l’ablazione. In generale, raccomandiamo comunque di eseguire un TEE prima della procedura in tutti i pazienti che presentino FA o che abbiano alto rischio di eventi trombotici.
Terapia anticoagulante durante la procedura di ablazione
L’anticoagulazione eparinica durante la procedura dovrebbe essere effettuata dopo l’esecuzione della puntura transettale e spesso è necessario mantenere un valore di ACT > 300 sec per ridurre il rischio di trombosi dell’introduttore.
Terapia anticoagulante post-ablazione
Quale sia il miglior protocollo per l’anticoagulazione nel post-procedura non è ancora stato stabilito. L’introduzione dei DOAC, con un migliore profilo di rischio e una maggiore facilità di impiego ha modificato le scelte terapeutiche rispetto all’utilizzo dei classici dicumarolici. A causa del rischio embolico nel post-procedura si invita il paziente ad osservare una terapia anticoagulante orale nei primi 3 o 4 mesi. In pazienti selezionati a basso rischio, se seguiti con monitoraggio ECG tramite loop recorder impiantabile e che non abbiano evidenza di episodi aritmici a distanza di 12 mesi dalla ablazione, è possibile considerare l’interruzione della terapia anticoagulante (che verrà eventualmente ripresa in caso di recidive tardive). In ogni caso i pazienti ad alto rischio tromboembolico dovrebbero continuare la terapia anticoagulante anche qualora non ci sia evidenza di ricorrenze aritmiche.
