Introduzione
Sin da quando fu introddotta come nuova entità clinica da Josep e Pedro Brugada nel 1992, la sindrome di Brugada ha suscitato grande interesse sia per la sua alta incidenza in alcune parti del mondo sia perché associata ad un incrementato rischio di morte cardiaca improvvisa in particolare nei maschi nella terza e quarta decade di vita. In quest’ultimi anni c’è stato un drammatico aumento nel numero di casi riportati ed una grande proliferazione di pubblicazioni scientifiche sull’argomento. Una prima consensus conference tenutasi nel 2002 ha definito i criteri diagnostici per la sindrome, una seconda C.C. nel 2005 ha posto attenzione sulla stratificazione del rischio e sulle terapie.
Criteri diagnostici
Caratterizzata da un sopraslivellamento del tratto ST nelle derivazioni precordiali destre e da un aumentata incidenza di morte cardiaca improvvisa in pazienti con cuore strutturalmente sano, la sindrome di Brugada generalmente dà manifestazione di se nell’età adulta. La media dell’età alla quale viene posta diagnosi è di 40 aa± 22. Poiché il pattern elettrocardiografico è caratterizzato da una certa dinamicità di presentazione e spesso è occulto, è molto difficile stimare quale sia la sua reale prevalenza nella popolazione generale. La prevalenza della sindrome di Brugada comunque nella popolazione mondiale non sembra superare 1-5 casi /10000. La frequenza è più bassa nei paesi occidentali e più alta nel Sud-Est asiatico specialmente in Tailandia e nelle Filippine dove la sindrome di Brugada è considerata la causa principale di morte improvvisa in giovani individui. In questi paesi, la sindrome è spesso definita come SUNDS (sudden unexplained nocturnal death syndrome).

Sono stati riconosciuti 3 pattern elettrocardiografici: Il tipo 1 è il pattern più evidente ed ovvio. E’ caratterizzato da V1 a V3 ( ma anche una sola derivazione è sufficiente) da una positività terminale del QRS (onda J) dalla quale si origina una larga onda a tenda, che rappresenta l’ST sopraslivellato; tale ST si può definire convesso superiormente, ma ha spesso l’aspetto di una linea retta obliqua che lentamente si porta verso l’isoelettrica , continuandosi poi insensibilmente con una T negativa. Nei tipi 2 e 3, al contrario, l’ST è concavo superiormente; la positività terminale del QRS (onda J) è di minore voltaggio che nel tipo 1 e inoltre più breve è il tragitto discendente dell’ST dal punto più elevato dell’onda J, mentre l’onda T è positiva o prevalentemente positiva. Per definizione il tipo 2 ha un sopraslivellamento di ST di 1 mm o più mentre il tipo 3 un’elevazione di ST minore di 1 mm. La polarità della T (negativa, positiva, isoelettrica) va analizzata solo nelle derivazioni in cui l’onda J è ben evidente. In ogni caso il voltaggio dell’onda J deve essere 2 mm o più per consentire la diagnosi. I tre tipi sopra descritti non corrispondono a differenti entità cliniche: è possibile riscontrare diverse morfologie in diverse derivazioni in uno stesso soggetto ed inoltre esiste in molti soggetti una notevole variabilità del quadro nel tempo, con transizione da un tipo all’altro e possibile scomparsa del segno di Brugada con normalizzazione dell’ECG. La somministrazione di farmaci bloccanti i canali del sodio accentua di solito le alterazioni dell’ECG e provoca la transizione dal tipo 2 o 3 al tipo 1. l’intervallo QTc è di solito normale ma risulta prolungato nelle derivazioni precordiali destre, specialmente dopo somministrazione di flecainide; questo dato non è sorprendente poiché alla base del fenomeno di Brugada vi è un allungamento del potenziale d’azione nelle cellule del tratto d’efflusso del ventricolo destro. E’ stato anche osservato che in alcuni casi di sindrome del QT lungo congenito tipo III la somministrazione di flecainide ha provocato la comparsa di un caratteristico segno di Brugada. Poiché le due affezioni (Brugada e LQTS3) possono entrambe dipendere da un’anomalia del gene SCN5A, non è impossibile la loro coesistenza in uno stesso individuo. Oltre al classico fenomeno di Brugada in cui il sopraslivellamento dell’ST e l’onda J compaiono nelle derivazioni precordiali destre, sono stati descritti casi in cui le alterazioni si manifestavano nelle derivazioni laterali o inferiori. È stata anche identificata una particolare mutazione del gene SCN5A associata a questo tipo di manifestazioni. In un caso era evidente non solo il sopraslivellamento del tratto ST e la T negativa in D2, D3, e AVF ma anche un rallentamento preterminale dell’onda R nelle stesse derivazioni; in questo paziente la morte improvvisa , registrata all’Holter-ECG era stata determinata non da fibrillazione ventricolare, ma da asistolia preceduta da un breve periodo di attività elettrica disordinata scatenata da un’extrasistole ventricolare precocissima. E’ stato perciò proposto di definire questo tipo di complesso come “onda lambda” a causa del suo aspetto simile alla lettera l dell’alfabeto greco suggerendo anche che in questa variante della sindrome di Brugada il meccanismo fondamentale della morte potrebbe essere l’asistolia più della fibrillazione ventricolare. A parte il sopraslivellamento di ST, il quadro ECG può comprendere anche:
– blocco A-V di I grado ; è stato riportato che il ritardo di conduzione è sottohissiano e che l’intervallo H-V è prolungato nella maggior parte dei pazienti;
– disturbi di conduzione intraventricolare; sono stati descritti casi di blocco di branca destra isolato (BBD) o associato a emiblocco anteriore sinistro (EAS). Nonostante sia stato ripetutamente affermato, in base alla presenza di una positività terminale del QRS in V1 V2, che il blocco di branca destra sia un carattere pressocchè obbligatorio del fenomeno di Brugada, in realtà non si tratta di un vero blocco di branca né di un ritardo di conduzione intraventricolare. La positività terminale del QRS nelle precordiali destre, infatti, non rappresenta un onda R’, espressione di attivazione ritardardata del ventricolo destro, ma una deflessione che si genera per il crearsi di un gradiente elettrico fra l’epicardio e l’endocardio del tratto di efflusso del ventricolo destro. Tale onda ha la stessa origine dell’onda J che si genera nell’ipotermia (onda di Osborn). A volte l’alterazione tipica dell’ECG nelle derivazioni precordiali destre è assente o appena accennata , ma compare o si accentua se gli elettrodi esploranti vengono collocati uno o due spazi intercostali sopra. I segni caratterizzanti il Brugada infatti possono essere indagati spesso solo su una porzione molto limitata del precordio e questo perché l’anomalia elettrofisiologia sottostante, coinvolge soltanto una limitata regione ventricolare destra, i cui potenziali vengono colti solo se gli elettrodi sono posti praticamente al di sopra della regione interessata.
Per poter definire una sindrome tuttavia non è necessario avere solo il segno ma anche il sintomo. La seconda consensus conference tenutasi nel 2005, ha affermato che per la diagnosi di sindrome di Brugada sia necessario non solo il caratteristico aspetto elettrocardiografico , ma anche almeno una delle seguenti condizioni: 1. fibrillazione ventricolare documentata; 2. tachicardia ventricolare polimorfa; 3. storia familiare di morte improvvisa in età < 45 anni; 4. ECG con onda j e sopraslivellamento convesso di ST in membri della famiglia; 5. indicibilità di tachicardia ventricolare con la stimolazione programmata; 6. sincope; 7. respiro agoico notturno.
Criteri diagnostici per la sindrome di Brugada (Consensus Conference 2005)

Ovviamente prima di poter fare diagnosi di sindrome di Brugada bisogna escludere tutte le altre condizioni cliniche benigne o maligne che possono dare un pattern elettrocardiografico Brugada-like. Nella fattispecie, le miocarditi, la displasia aritmogena del ventricolo destro, alcuni farmaci o semplicemente pazienti che paticano una intensa attività sportiva possono mimare un quadro elettrocardiografico simile al Brugada.
Mecanismi cellulari e ionici
L’onda J deriva da un’ alterazione del potenziale d’azione che coinvolge le cellule epicardiche, ma non quelle endocardiche, durante la fase 1. in questo periodo (fase di ripolarizzazione precoce) esistono due correnti ioniche ripolarizzanti: il potassio tende a fuoriuscire (corrente Ito) e il cloro a penetrare nella cellula(corrente Icl); intanto la corrente sodica di ingresso (Ina late), si attenua progressivamente fino a scomparire . come conseguenza della perdita di cariche positive e dell’acquisizione di cariche negative, il potenziale transmembrana si porta verso valori meno positivi passando da circa +30mV a 0 mV. La corrente sodica d’ingresso (Ina late) ha un effetto opposto a quello di Ito e Icl,e portando cariche positive all’interno della cellula, rallenta la ripolarizzazione; tuttavia, poiché essa si esaurisce rapidamente, in condizioni fisiologiche la sua importanza è relativa. Nei soggetti che presentano il fenomeno di brugada, la ripolarizzazione procede più in fretta che di norma durante la fase 1, con rapida riduzione del potenziale da 30 mV a 0 mV o a valori più negativi.
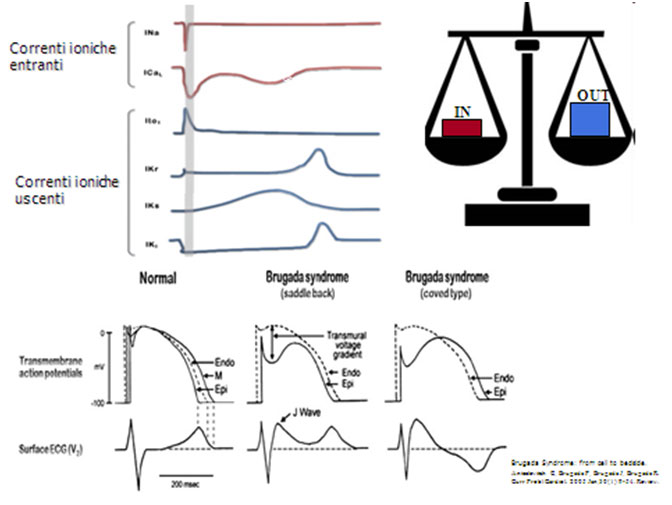
Meccanismo proposto per l’elevazione del tratto ST nella sindrome di Brugada . L’intaccatura presente in fase 1 a livello epicardico ma non endocardico da origine ad un gradiente transmurale e quindi all’elevazione al punto J. L’accentuazione di questa intaccatura potrebbe essere accompagnata da un prolungamento del potenziale d’azione nell’epicardio che diventa più lungo di quello endocardico portando alla formazione di un’onda T negativa.
Il fenomeno si deve al malfunzionamento del canale del sodio, che provoca una precoce riduzione e/o in attivazione della Ina-late: venendo meno l’ingresso di cariche positive ,la fuoriuscita di ioni K (Ito), non più controbilanciata, induce una rapida caduta della positività intracellulare. Il potenziale d’azione delle cellule affette assume perciò un aspetto definito spike-and-dome (punta e cupola). Questo fenomeno si realizza esclusivamente nelle cellule epicardiche, mentre quelle endocardiche conservano un potenziale d’azione normale. Si viene così a creare un gradiente elettrico, cioè una differenza di potenziale tra endocardio ed epicardio; il gradiente elettrico transmurale che si realizza è responsabile del sopraslivellamento del tratto ST, che si identifica con l’onda J. Quest’onda si verifica solo nelle precordiali destre, perché il potenziale epicardico tipo spike-and-dome, si realizza esclusivamente a livello del tratto d’efflusso del ventricolo destro. Si tratta quindi di un fenomeno locale. Questa interpretazione basata su osservazioni compiute in preparati sperimentali costituiti da strisce isolate di miocardio, ha ricevuto conferme cliniche seppur limitate. In uno studio una guida coronaria contenente un elettrodo è stata introdotta nell’arteria del cono, ramo della coronaria destra, per registrare l’attività elettrica dell’infundibolo, e in tutti e cinque i pazienti studiati affetti da sindrome di Brugada, sono stati riscontrati potenziali tardivi, separati dal QRS, registrabili solo a livello infundibolare, sincroni con l’onda J dell’ECG. L’elettrogenesi dell’onda J spiega perché i farmaci bloccanti i canali del sodio accentuino il fenomeno di Brugada: poiché la causa prima del sopraslivellamento di ST è il deficit della corrente entrante Ina-late, un farmaco che riduca ancora di più questa corrente provocherà necessariamente un’amplificazione del fenomeno o potrà slatentizzarlo se esso non è evidente, mentre un farmaco che riduca la corrente Ito potrà attenuarlo.
Le aritmie nella sindrome di Brugada.
È nota a tutti la possibilità che la morte improvvisa colpisca i portatori del fenomeno di Brugada, soprattutto in maschi in età giovanile (l’età media della morte è 41±15 anni), e possa avere un andamento familiare. L’aritmia tipica della sindrome di Brugada è una tachicardia ventricolare polimorfa che spesso degenera in fibrillazione ventricolare . L’aritmia non si verifica solo a causa del gradiente transmurale che si manifesta a livello infundibolare durante la fase 1 del potenziale d’azione, ma riconosce un meccanismo di rientro in fase 2. il rischio aritmico compare solo quando l’alterazione dei flussi ionici transmembrana, risulta di entità tale da provocare, in alcune regioni dell’epicardio infundibolare, la perdita della fase di plateau con conseguente notevole accorciamento del potenziale d’azione. Poiché tale fenomeno interessa esclusivamente le cellule subepicardiche risparmiando quelle subendocardiche e, nell’ambito dello strato subepicardico, mostra una marcata eterogeneità zonale, si determina una rilevante differenza di refrattarietà tra l’endocardio e l’epicardioe fra diverse zone dell’epicardio. Durante la fase 2 del potenziale d’azione perciò, si crea un gradiente elettrico fra diversi gruppi di cellule (dispersione transmurale ed epicardica della ripolarizzazione), e quelle con potenziale accorciato e breve refrattarietà, possono essere rieccitate, iniziando un movimento di propagazione dell’impulso,, che può degenerare in una tachicardia o in una fibrillaione ventricolare. L’extrasistole determinata dal rientro in fase 2 è difficilmente riconoscibile perché precocissima e anche perché l’impulso prematuro depolarizza una quantità modesta di miocardio (quello eccitabile); verosimilmente il battito prematuro deforma l’onda T, più che manifestarsi come un vero QRS. Un’alterazione dell’onda T, è stata osservata in coincidenza con lo scatenamento della tachicardia ventricolare in molti pazienti con sindrome di Brugada. Oltre alla tachicardia e alla fibrillazione ventricolare è stata descritta in soggetti con sindrome di Brugada un’elevata incidenza di aritmie atriali, soprattutto fibrillazione atriale parossistica.
La genetica nella sindrome di Brugada
L’ereditarietà della sindrome di Brugada sembra seguire un modello di trasmissione autosomico dominante a penetranza variabile, sebbene siano conosciute delle forme sporadiche. La prima mutazione associata alla sindrome fu scoperta da Chen e collaboratori ed è stata identificata nel gene SCN5A codificante la subunità a del canale cardiaco del sodio (locus 3p21, 28 esoni). Attualmente nello stesso gene sono state riconosciute più di 80 mutazioni associate alla sindrome. Studi funzionali eseguiti con sistemi di espressione genica , hanno dimostrato che la maggior parte
delle mutazioni porta ad una perdita di funzione del canale del sodio attraverso vari meccanismi:
– un decremento quantitativo nei canali del sodio a causa di una loro insufficiente espressione
– una disfunzione qualitativa dei canali del sodio imputabili a squilibri nelle cinetiche di attivazione- in attivazione del canale.

Fig 2.Esempio di 2 differenti tipi mutazioni nell’SCN5A che portano alla perdita di funzione del canale del sodio (Na). A, Mutazione I1660V; produce un difetto nel trafficking cellulare del canale del sodio che porta ad un decremento dei canali del sodio presenti nel sarcolemma . I canali del sodio mutati e wild type (WT) sono stati espressi in cellule della linea TSA201 e marcate con una proteina fluorescente (GFP) A-I, I canali WT sono presenti sia all’interno della cellula che a livello della membrana suggerendo che i canali vengono prodotti a livello degli organelli e successivamente trasferiti sulla membrana. A-II, la distribuzione della fluorescenza dei canali I1660V è essenzialmente localizzata negl’organelli intracellulari, il che suggerisce che I canali mutati vengono prodotti normalmente ma rimangono intrappolati all’interno della cellula.The fluorescence distribution of I1660V channels is essentially localized in intracellular organelles, which suggests that mutant channels are manufactured but remain trapped within the cell. A-III, Recupero del canale mutato con incubazione a temperatura ambiente. Modificato da Cordeiro et al. B, Mutazione G1319V che modifica le cinetiche del canale del sodio. Studi funzionali attuati in cellule della linea HEK-293. B-I, I picchi massimi d’ampiezza della corrente sono simili nei WT e nelle cellule mutate, indicando che il numero dei canali funzionali è simile. B-II,Attivazione voltaggio dipendente che mostra uno shift nella depolarizzazione nei canali mutati rispetto ai WT senza nessun cambiamento nelle pendenze delle curve. B-III, L’inattivazione voltaggio dipendente allo steady-state risulta aumentata nei canali mutati rispetto ai WT. B-IV,Il recupero dall’inattivazione è marcatamente più lento nei canali G1319V.
La mutazione del gene SCN5A in ogni caso attualmente viene riscontrata in una percentuale di pazienti che va dal 18% al 30%, questo dato suggerisce che all’interno della patologia ci sia una certa eterogeneità genetica. In accordo con questa ipotesi,tramite posizionamento clonale è stato identificato in una grande famiglia di pazienti affetti da sindrome di Brugada, un locus differente sul cromosoma 3, non collegato all’SCN5A. il gene coinvolto è stato recentemente descritto ed è la Glicerolo 3-P deidrogenasi che sembra avere un ruolo nel trafficking dei canali del sodio sulla superficie cellulare. La mutazione responsabile (A280V) riduce le correnti di sodio entranti del 50%. Recenti studi hanno inoltre dimostrato che anche mutazioni comportanti la perdita di funzione del canale del calcio cardiaco CACNA1c e della sua subunità b possono portare ad una sindrome che si pone a metà strada tra Brugada e sindrome del QT corto. Tutti questi dati fanno inquadrare la s. di Brugada in una canalopatia comportante uno squilibrio tra correnti entranti e correnti uscenti del sodio. Negl’ultimi anni lo studio dei polimorfismi sta acquisendo grande importanza per spiegare i fenotipi di certe malattie genetiche. Ad esempio nel locus SCN5A il polimorfismo H558R comporta un fenotipo più lieve della sindrome associandosi ad un minor squilibrio tra correnti entranti e correnti uscenti del sodio .
Il test con farmaci bloccanti i canali del sodio
È stato proposto di utilizzare la somministrazione di farmaci bloccanti la corrente Ina per la diagnosi della sindrome di Brugada. Il test ha un suo evidente substrato biologico, poiché la depressione della corente sodica sbilancia l’equilibrio dei flussi ionici transmembrana a favore della corrente ripolarizzante Ito, con conseguente aumento dell’onda J e del sopraslivellamento di ST nelle precordiali destre. Ad accentuare il fenomeno di Brugada, però, sono i farmaci antiaritmici che influenzano solo Ina e non Ito (disopiramide, procainamide, ajmalina, flecainide); al contrario i farmaci che deprimono anche Ito oltre che Ina, come la chinidina, non solo non accentuano l’onda J e il sopraslivellamento di ST, ma possono addirittura controbilanciare il fenomeno elettrico, tanto che in alcuni casi la somministrazione di chinidina è in grado di normalizzare l’ECG.
Il farmaco è stato anche utilizzato con successo per la prevenzione delle aritmie in pazienti affetti dalla sindrome. Nonostante siano stati testati diversi farmaci di classe 1 per il test farmacologico, l’importanza clinica di quest’ultimo è stato più volte messo in discussione. Brugada ha rilevato un’elevata sensibilità del test, mentre altri hanno osservato un potere predittivo positivo, nei confronti di un successivo arresto cardiaco, solo del 7,9 %, con un valore predittivo negativo del 95%, una sensibilità dell’88% e una specificità del 22%. È stato sottolineato come il test con i farmaci bloccanti i canali de sodio, non sia utile nei pazienti con quadro ECG tipo 1, mentre resti proponibile in quelli con quadro ECG tipo 2 e 3. In quest’ultimi il test è positivo quando il farmaco induce una trasformazione del quadro ECG nel tipo 1, caratterizzato da sopraslivellamento convesso (coved) di ST con T negativa. Occorre comunque sottolineare che il test non è privo di rischi: somministrando questi farmaci a soggetti con fenomeno di Brugada sospetto o evidente ma non diagnostico, è possibile non solo slatentizzare il tipico sopraslivellamento convesso, ma anche indurre aritmie potenzialmente letali come tachicardia e fibrillazione ventricolare o dissociazione elettromeccanica.
| Farmaco | Dosaggio | Somministrazione |
| Ajmaline | 1 mg/kg in 5 min | IV |
| Flecainide | 2 mg/kg in 10 min | IV |
| 400 mg | PO | |
| Procainamide | 10 mg/kg in 10 min | IV |
| Pilsicainide | 1 mg/kg in 10 min | IV |
Lo studio elettrofisiologico
Poiché i pazienti con sindrome di Brugada sono a rischio di morte improvvisa, ci si è chiesti se l’inducibilità di aritmie ventricolari sostenute mediante stimolazione programmata potesse permettere di riconoscere, nel gruppo di soggetti che presentano il fenomeno di Brugada, quelli che sono a rischio di sviluppare spontaneamente tachicardia o fibrillazione ventricolare. Come per il test alla flecainide, le opinioni dei ricercatori non sono concordi: alcuni riportano un elevato potere predittivo dello studio elettrofisiologico nei confronti della morte improvvisa o della tachicardia ventricolare, mentre altri sostengono che la stessa non sia in grado di discriminare i soggetti a rischio da quelli non a rischio. Allo stato attuale è comunque uno dei pochi test utili disponibili per una adeguata stratificazione del rischio specie quando manchi una sintomatologia caratteristica o una familiarità.
Terapie
Defibrillatore automatico impiantabile (ICD)
L’ ICD è l’unica terapia di provata efficacia in prevenzione della morte cardiaca improvvisa. Le raccomandazioni per l’impianto dell’ICD sono riassunte qui di seguito:
– Pazienti sintomatici che mostrano un pattern di tipo 1 sia spontaneo che dopo somministrazione di farmaci bloccanti i canali del sodio che hanno sperimentato un arresto cardiaco resuscitato dovrebbero impiatare un ICD senza ulteriori accertamenti.
– Pazienti con sintomi quali sincope, respiro agonico notturno, prelipotimie, una volta escluse tutte le cause non cardiache di questi, dovrebbero ricevere un ICD. Lo studio elettrofisiologico dovrebbe essere utilizzato per screenare l’eventuale coesistenza di aritmie sopraventricolari.
– Pazienti asintomatici che mostrano un pattern ECG Brugada dovrebbero essere sottoposti ad uno studio elettrofisiologico che accerti la possibile inducibilità di aritmie ventricolari maligne. Qualora lo studio elettrofisiologico risulti positivo, i pazienti dovrebbero ricevere un ICD.
– Pazienti asintomatici senza una storia familiare accertata, con un pattern brugada solo inducibile, dovrebbero essere sottoposti ad uno stretto follow-up.
Approccio farmacologico
Sebbene L’ICD rimanga il cardine della terapia del Brugada, non sempre risulta facilmente accessibile soprattutto a causa delle limitazioni economiche di quei paesi dove peraltro, il tasso di incidenza è superiore. L’obiettivo della terapia farmacologica è quello di riequilibrare le correnti ioniche cercando di minimizzare la differenza di potenziale che si crea tra le cellule che conservano una normale morfologia del potenziale d’azione e quelle con potenziale spike and dome (vedi elettrogenesi ). Tale differenza di potenziale infatti è alla base del meccanismo del rientro in fase 2 responsabile dell’innesco delle aritmie ventricolari. Farmaci antiaritmici quali la quinidina e la disopiramide si sono dimostrati efficaci nel normalizzare il sopraslivellamento del tratto ST in quanto vanno ad interagire con le correnti Ito. In un recente studio attuato su 25 pazienti con sindrome di Brugada, la chinidina è risultata efficace nel prevenire l ‘ induzione di fibrillazione ventricolare allo studio elettrofisiologico (22 pz/25pz). L’approccio farmacologico necessita tuttavia di ulteriori studi per accertarne l’efficacia e la sicurezza.
- Category
- Aritmie Adulti /Pediatrici
